Los científicos han resuelto el misterio de un asesinato celular casi 25 años después de que el caso se cerrara.
por la Universidad de California – Santa Bárbara
Siguiendo un rastro de evidencia desde moscas de la fruta hasta ratones y humanos, se reveló que las células caníbales probablemente causan una rara inmunodeficiencia humana. Ahora el descubrimiento parece prometedor para mejorar un prometedor tratamiento contra el cáncer.
«Este artículo nos lleva desde la biología celular fundamental de una mosca hasta la explicación de una enfermedad humana y el aprovechamiento de ese conocimiento para una terapia contra el cáncer «, dijo Denise Montell, de UC Santa Barbara. «Cada uno de esos pasos parece un descubrimiento importante, pero aquí están, todos en un solo documento».
Los investigadores del laboratorio de Montell publicaron sus hallazgos en las Actas de la Academia Nacional de Ciencias y ahora están investigando los mecanismos y las implicaciones.
Un gen antiguo
El personaje principal de esta historia es un gen, Rac2 , y la proteína que codifica. Rac2 es uno de los tres genes Rac en humanos. «Rac tiene una evolución muy antigua, por lo que debe cumplir una función fundamental», dijo el autor principal Montell, profesor Duggan y profesor distinguido de biología molecular, celular y del desarrollo.
Las proteínas rac ayudan a construir el andamiaje de una célula, llamado citoesqueleto. El citoesqueleto está formado por filamentos dinámicos que permiten a las células mantener su forma o deformarse, según sea necesario. En 1996, mientras estudiaba un pequeño grupo de células en el ovario de la mosca de la fruta, Montell determinó que las proteínas Rac desempeñan un papel decisivo en el movimiento celular. Desde entonces, ha quedado claro que Rac es un regulador casi universal de la motilidad celular en las células animales.
En los años 90, observó que una forma hiperactiva de la proteína Rac1, expresada en sólo unas pocas células en la cámara de huevos de una mosca, destruía todo el tejido. «La simple expresión de este Rac activo en seis a ocho células mata todo el tejido, que está compuesto por unas 900 células», explicó el autor principal Abhinava Mishra, científico del proyecto en el laboratorio de Montell.
¿Por qué pasó esto? ¿Como funciona? «Este era nuestro caso sin resolver hace 25 años», dijo Montell.
Hace unos años, comenzaron a acumularse pruebas que implicaban la alimentación de células, también conocida como canibalismo, en la destrucción de tejidos. Hay un paso en el desarrollo normal de los huevos de mosca en el que ciertas células similares a las células fronterizas consumen a sus vecinas porque ya no son necesarias. De hecho, el canibalismo celular no es tan raro como cabría esperar: de esta manera se eliminan del cuerpo humano millones de glóbulos rojos viejos cada segundo.
Rac2 es un componente del complejo proceso de alimentación. Rac ayuda a la célula devoradora a envolver a su objetivo. El equipo tenía curiosidad por saber si una forma hiperactiva de la proteína estaba provocando que las células fronterizas consumieran prematuramente a sus vecinas.
Para que esto ocurra, las células fronterizas necesitan reconocer sus objetivos, lo que requiere un receptor particular. De hecho, cuando Mishra bloqueó este receptor, las células fronterizas que expresaban Rac activado no consumieron a sus vecinas y la cámara de óvulos permaneció viva y saludable.
«Nuestro caso sin resolver de hace 25 años se resolvió y eso fue muy satisfactorio para nosotros», exclamó Montell. «Pero ésta es un área bastante específica del desarrollo de los óvulos de Drosophila». Sin embargo, las implicaciones pronto crecerían.
Una misteriosa condición inmune
En la época en que su laboratorio logró su gran avance, Montell se enteró de un estudio intrigante en la revista Blood . Este artículo encontró que tres personas no relacionadas que padecían infecciones recurrentes tenían exactamente la misma mutación, que hiperactiva Rac2, una proteína Rac producida en las células sanguíneas. Sospechaba que la reciente revelación de su laboratorio sobre las moscas de la fruta podría arrojar luz sobre este enigma.
La mutación de los pacientes fue sólo ligeramente activadora, pero fue suficiente para que todos sufrieran múltiples infecciones y finalmente necesitaran trasplantes de médula ósea . Los análisis de sangre revelaron que estos pacientes casi no tenían células T, un tipo especializado de glóbulos blancos cruciales para el sistema inmunológico. El equipo de los Institutos Nacionales de Salud insertó la mutación Rac2 en ratones y encontró la misma misteriosa pérdida de células T. También descubrieron que las células T con Rac hiperactivo se desarrollaban normalmente en la médula ósea de los animales y migraban al timo, donde continuaban madurando sin incidentes. Pero luego parecieron desaparecer. Entonces, el artículo terminó con un misterio: ¿qué estaba causando la desaparición de las células T?
Los autores de ese estudio de la revista habían notado que muchos de los neutrófilos de los pacientes (otro tipo de glóbulo blanco) estaban agrandados. Parecían estar consumiendo una gran cantidad de material, un comportamiento inusual en una persona por lo demás sana.
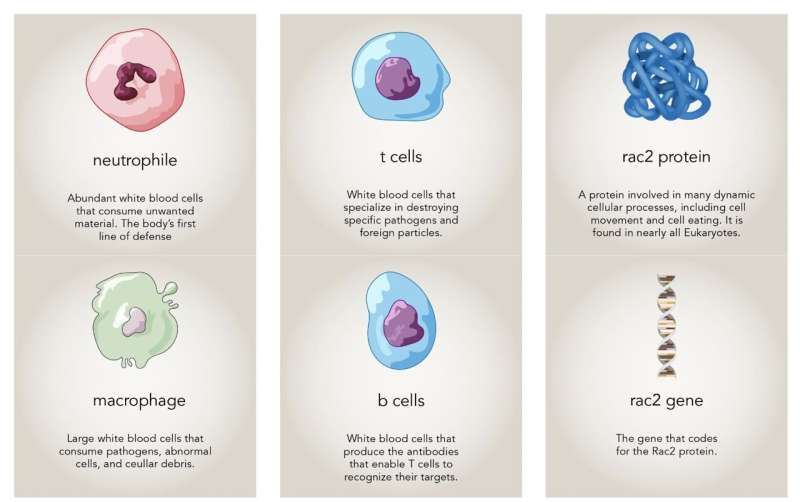
Montell se preguntó si las células T de los pacientes estaban desapareciendo porque sus células inmunes innatas, como los neutrófilos con Rac2 activo, se las estaban comiendo, de manera muy similar a como las células fronterizas de la mosca de la fruta con Rac activo se estaban comiendo la cámara de los huevos. Su equipo centró su atención en los macrófagos (la contraparte más voraz de los neutrófilos) para investigar. Mishra cultivó macrófagos humanos con y sin Rac2 hiperactivo junto con células T. Observó que los macrófagos con Rac hiperactivo consumían más células, confirmando la hipótesis del grupo a partir de su trabajo con moscas de la fruta.
Para probar si esto podría causar la inmunodeficiencia observada, la coautora Melanie Rodríguez (estudiante de posgrado en el laboratorio de Montell) tomó muestras de médula ósea de ratones con la misma mutación hiperactiva de Rac2 encontrada en los pacientes. Luego cultivó las células madre de la médula ósea hasta convertirlas en macrófagos y realizó un experimento similar al de Mishra, pero esta vez mezclando macrófagos y células T con y sin la mutación Rac2 .
Descubrió que los macrófagos con Rac2 activo consumían significativamente más células T que sus homólogos normales. Sin embargo, las células T con Rac2 activo también eran más vulnerables al consumo de cualquier tipo de macrófago. Entonces, la explicación más probable para la falta de células T de los pacientes fue una combinación de un mayor consumo por parte de los macrófagos, así como una mayor vulnerabilidad de las propias células T. Se resolvió un misterio médico humano basándose en observaciones fundamentales en moscas de la fruta.
Aprovechar las células descontroladas
Las implicaciones de estos conocimientos se ampliaron en enero de 2020, cuando la coautora Meghan Morrissey fue entrevistada para un puesto docente en UCSB. En su charla describió la programación de macrófagos para que coman células cancerosas como un tratamiento novedoso para la enfermedad, un enfoque llamado CAR-M. Morrissey había descubierto que añadir un receptor CAR a los macrófagos promovía este comportamiento. Pero también estaba claro que inducir a los macrófagos a comer más haría que el enfoque fuera más eficaz, especialmente si consumieran y mataran específicamente células cancerosas enteras.
Bueno, si había algo que Montell y su laboratorio habían aprendido era cómo hacer que los macrófagos coman y maten células vivas enteras. Entonces colaboraron con Morrissey, ahora profesor asistente de biología molecular, celular y del desarrollo, para determinar si agregar Rac2 activado aumentaría la efectividad del enfoque CAR-M.
Rodríguez cultivó macrófagos a partir de la médula ósea de ratones normales y mutantes con Rac2 activado. En cada uno de estos grupos, Morrissey expresó un receptor ficticio o el receptor CAR, que reconoce las células B (otro tipo de glóbulo blanco). Descubrieron que las células Rac normales e hiperactivas con receptores ficticios no comían muchos objetivos de células B. Los macrófagos normales con receptores CAR consumieron muchas más células B, como había demostrado previamente Morrissey. Sin embargo, los macrófagos con receptores Rac y CAR hiperactivos comieron el doble de células B que el grupo que solo tenía CAR. La activación de Rac2 también pareció aumentar el número de los llamados «súper comedores», macrófagos voraces que comen y matan múltiples células cancerosas.
Los resultados dejaron en claro que tanto Rac activado como el receptor eran necesarios para lograr un efecto mejorado. «Si agrega Rac activo sin el receptor correcto, no hace nada», explicó Montell.
Este nivel de control es una buena noticia para cualquier tratamiento potencial porque daría a los médicos una forma de centrar el ataque de los macrófagos modificados en las células cancerosas. Es de esperar que los médicos tampoco tengan que preocuparse de que las células diseñadas se coman las células T del paciente, porque las células T no tendrían la mutación Rac2 activa que las haría más vulnerables a esto, como Rodríguez había descubierto previamente.
Actualmente existe un tratamiento contra el cáncer llamado CAR-T, que utiliza el receptor CAR y las propias células T del paciente para atacar y destruir los cánceres. Es muy eficaz contra algunos cánceres, pero hay muchos que no responden. CAR-M, un primo más reciente de CAR-T, ha entrado recientemente en ensayos clínicos en humanos y hasta ahora parece seguro. Montell y su grupo están interesados en aprovechar los macrófagos CAR mejorados con Rac para aumentar la eficacia de los tratamientos CAR-M. Han presentado una patente provisional para la técnica, a la que llaman Race CAR-M, y están invitando a empresas de biotecnología a asociarse para seguir desarrollando el enfoque.
Este nuevo artículo multifacético plantea cuestiones tanto científicas básicas como prácticas, que el laboratorio ha comenzado a abordar. Están investigando si la técnica, que es tan efectiva en el laboratorio, también funcionará en células inmunes humanas recién recolectadas y en modelos animales de cáncer, en ratones y peces cebra. El equipo también está explorando cómo Rac2 hace que todo esto suceda a nivel molecular, en lo más profundo de las células .
Más adelante, Montell quiere saber cuántos tipos de cáncer podría abordar con éxito el tratamiento RaceCAR-M. En comparación, CAR-T ha sido eficaz contra cánceres como la leucemia y el linfoma, pero no contra cánceres de tumores sólidos como el de mama, pulmón o colon.
Los resultados han asombrado a Montell, una estimada bióloga celular con más de 100 artículos a su nombre. «Este es mi periódico favorito hasta ahora», dijo.
«Tuvimos este caso sin resolver de hace 25 años sobre moscas de la fruta y lo resolvimos», añadió Montell. «Y eso nos ayudó a resolver el misterio de una inmunodeficiencia humana inexplicable. Y luego aprovechamos ese conocimiento para mejorar una posible inmunoterapia contra el cáncer.
«Era sólo un misterio tras otro, y Rac resultó ser la respuesta a cada uno de ellos».
Más información: Abhinava K. Mishra et al, Hyperactive Rac estimula el canibalismo de las células diana vivas y mejora la destrucción de células cancerosas mediada por CAR-M, Actas de la Academia Nacional de Ciencias (2023). DOI: 10.1073/pnas.2310221120
