La enfermedad de Alzheimer (EA) sigue siendo uno de los trastornos neurodegenerativos más desafiantes y prevalentes y afecta a millones de personas en todo el mundo.
por VIB (el Instituto de Biotecnología de Flandes)
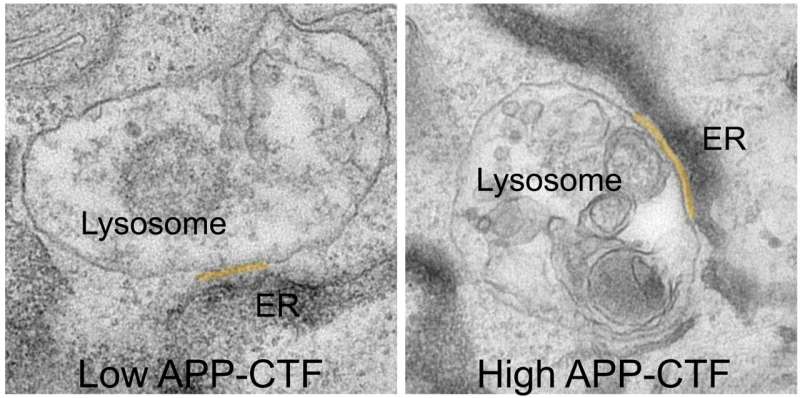
En un nuevo estudio publicado en Developmental Cell , investigadores del laboratorio de Wim Annaert (VIB-KU Leuven) han identificado un mecanismo novedoso potencialmente relacionado con las primeras etapas de la EA. Demostraron que un fragmento de la proteína precursora de amiloide (APP), llamada APP-CTF, interrumpe la comunicación entre compartimentos celulares cruciales para el almacenamiento de calcio y la eliminación de desechos, lo que podría ser un evento temprano que precede a la muerte de las células neuronales.
Estos hallazgos, con posibles implicaciones para el desarrollo de nuevos tratamientos para la EA, sugieren que es necesario tener en cuenta la prevención de la acumulación de APP-CTF para desarrollar tratamientos más eficaces.
La enfermedad de Alzheimer se caracteriza por la pérdida progresiva de la función cognitiva, deterioro de la memoria y cambios de comportamiento. Una de las características visibles en el cerebro de las personas con enfermedad de Alzheimer es la formación de placas amiloides: grupos de péptidos β-amiloide (Aβ), que son productos degradados de la proteína precursora de amiloide (APP). Estos fragmentos Aβ se acumulan en las neuronas en las primeras etapas de la enfermedad, incluso antes de que se observe el deterioro cognitivo.
La nueva investigación, sin embargo, sugiere que incluso podrían ocurrir eventos anteriores en el cerebro con EA antes de la formación de la placa y que la proteína APP desempeña un papel en estas primeras etapas. El mecanismo detrás de esto sigue siendo un misterio hasta ahora.
En su último estudio, el laboratorio de Annaert en el Centro VIB-KU Leuven para la Investigación del Cerebro y Enfermedades identificó un mecanismo que explica cómo la APP puede contribuir a estas primeras etapas de la EA. Este descubrimiento podría conducir a una nueva dirección en la investigación y los enfoques de tratamiento de la EA.
Interrumpir la comunicación celular
La APP se encuentra en las membranas celulares de las células cerebrales. El cerebro produce constantemente nuevas moléculas de APP mientras descompone y elimina las antiguas. Este proceso implica tijeras enzimáticas, siendo la gamma-secretasa la última que genera los conocidos y estudiados péptidos Aβ en la EA.
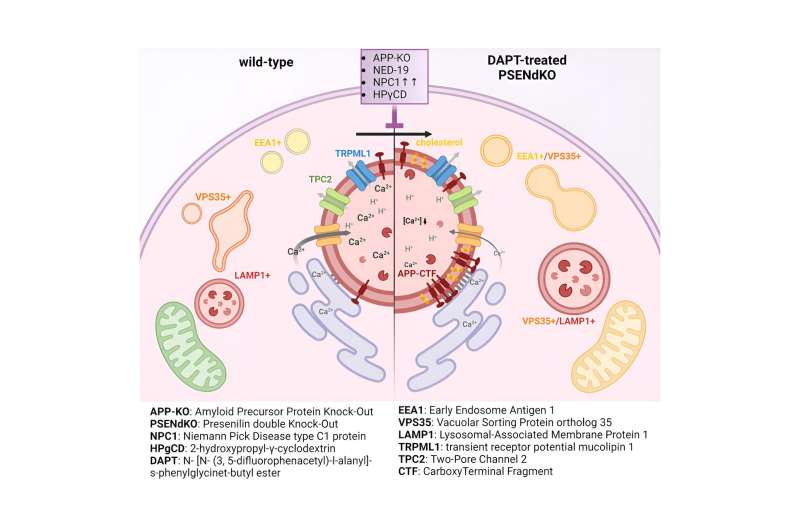
Durante mucho tiempo se pensó que bloquear la gamma-secretasa sería el paso lógico para prevenir la producción de fragmentos tóxicos de Aβ. Sin embargo, esto conduce a la acumulación de su precursor, los fragmentos terminales APP-C o APP-CTF. Ahora, los investigadores han descubierto que estos fragmentos también son tóxicos para las neuronas. Parecen acumularse entre el retículo endoplásmico (RE), el compartimento crucial para la síntesis de lípidos y el almacenamiento de calcio, y los lisosomas, los llamados «contenedores de basura» de las neuronas, que son fundamentales para degradar los productos de desecho de las células.
«Al hacerlo, los APP-CTF alteran el delicado equilibrio del calcio dentro de los lisosomas», explica la Dra. Marine Bretou, primera autora del estudio. «Esta alteración desencadena una cascada de acontecimientos. El ER ya no puede rellenar eficazmente los lisosomas con calcio, lo que provoca una acumulación de colesterol y una disminución de su capacidad para descomponer los desechos celulares. Esto provoca el colapso de todo el sistema endolisosomal, un vía crucial para mantener las neuronas sanas».
El nuevo estudio respalda además que los APP-CTF resultantes de la supresión de la gamma-secretasa podrían en realidad ser los culpables de la disfunción endolisosomal, como se observa en las primeras etapas de la EA.
Un cambio de paradigma en la comprensión de las primeras etapas de la patogénesis de la EA
Esta investigación avanza significativamente nuestra comprensión de las posibles causas de la enfermedad en las primeras etapas de la EA. Un resultado notable de este estudio es que estas primeras etapas podrían ser causadas por otro fragmento de la misma molécula de APP en lugar de Aβ.
Esto tiene implicaciones importantes para los enfoques terapéuticos actuales que tienen como objetivo eliminar las placas amiloides del cerebro con EA, ya que tienden a ignorar los efectos tóxicos de otros fragmentos. Otros intentos se centran en las proteínas tau o la neuroinflamación, que son otras características de la progresión de la EA que apuntan a eventos posteriores. Sin embargo, es probable que la intervención temprana sea la clave para detener o incluso prevenir la EA.
«El fracaso de los ensayos clínicos con inhibidores de la gamma-secretasa puede explicarse por el hecho de que nos estábamos centrando en un solo culpable y en una fase demasiado avanzada de la enfermedad», explica el profesor Annaert, autor principal del estudio.
«Los hallazgos de nuestra investigación sugieren que los moduladores de la gamma-secretasa , que pueden ayudar a promover la eliminación de los APP-CTF tóxicos sin bloquear completamente la enzima, pueden ser un objetivo más relevante para la intervención temprana en la EA. La clave podría ser encontrar el equilibrio adecuado entre APP- Eliminación de CTF y prevención de placa».
De cara al futuro, los científicos están uniendo esfuerzos con sus colegas para desarrollar estos moduladores basándose en estos nuevos conocimientos y continuarán explorando la homeostasis celular en las primeras etapas de la EA.
Más información: Marine Bretou et al, La acumulación de fragmentos C-terminales de APP provoca disfunción endolisosomal a través de la desregulación del endosoma tardío en los sitios de contacto lisosoma-ER, Developmental Cell (2024). DOI: 10.1016/j.devcel.2024.03.030
