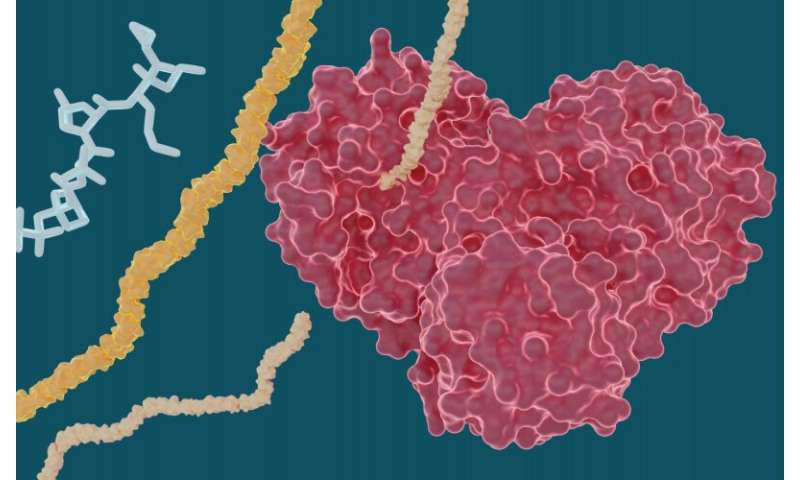
Los experimentos dirigidos por investigadores del Laboratorio Nacional de Oak Ridge del Departamento de Energía han determinado que varios medicamentos contra la hepatitis C pueden inhibir la proteasa principal del SARS-CoV-2, una enzima proteica crucial que permite la reproducción del nuevo coronavirus.
por el Laboratorio Nacional Oak Ridge
Inhibir o bloquear el funcionamiento de esta proteasa es vital para evitar que el virus se propague en pacientes con COVID-19. El estudio, publicado en la revista Structure , es parte de los esfuerzos para desarrollar rápidamente tratamientos farmacéuticos para COVID-19 mediante la reutilización de medicamentos existentes que se sabe que tratan de manera efectiva otras enfermedades virales.
«Actualmente, no hay inhibidores aprobados por la Administración de Alimentos y Medicamentos que se dirijan a la proteasa principal del SARS-CoV-2», dijo el autor principal de ORNL, Daniel Kneller. «Lo que encontramos es que los medicamentos contra la hepatitis C se unen e inhiben la proteasa del coronavirus. Este es un primer paso importante para determinar si estos medicamentos deben considerarse como posibles candidatos de reutilización para tratar el COVID-19».
El coronavirus SARS-CoV-2 se propaga mediante la expresión de largas cadenas de poliproteínas que deben ser cortadas por la proteasa principal para convertirse en proteínas funcionales, lo que convierte a la proteasa en un objetivo importante para los investigadores y desarrolladores de fármacos.
En el estudio, el equipo examinó varias moléculas de fármacos bien conocidas para posibles esfuerzos de reutilización, incluida la leupeptina, un inhibidor de la proteasa de origen natural , y tres inhibidores de la proteasa de la hepatitis C aprobados por la FDA: telaprevir, narlaprevir y boceprevir.
El equipo realizó mediciones de rayos X a temperatura ambiente para construir un mapa tridimensional que reveló cómo estaban dispuestos los átomos y dónde se formaban los enlaces químicos entre la proteasa y las moléculas inhibidoras del fármaco.
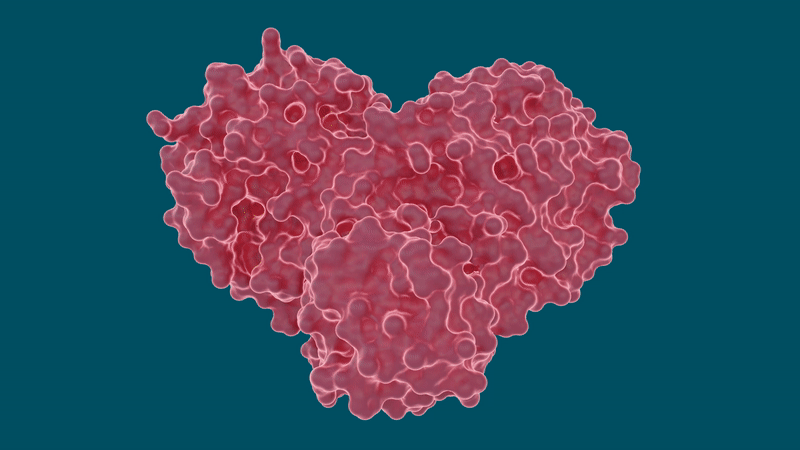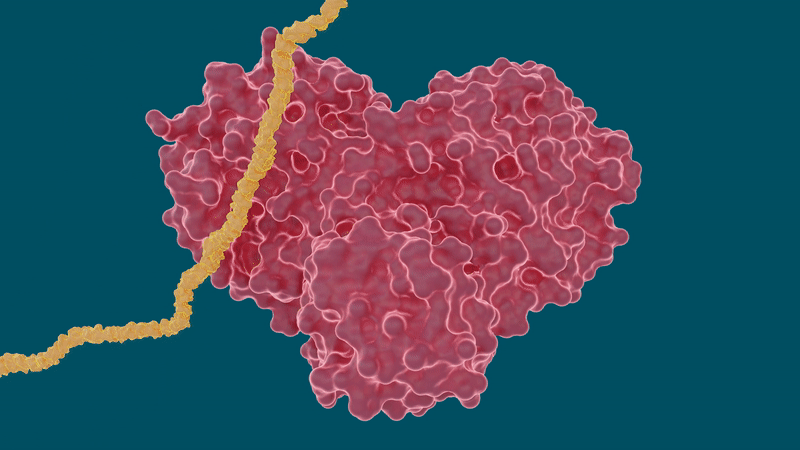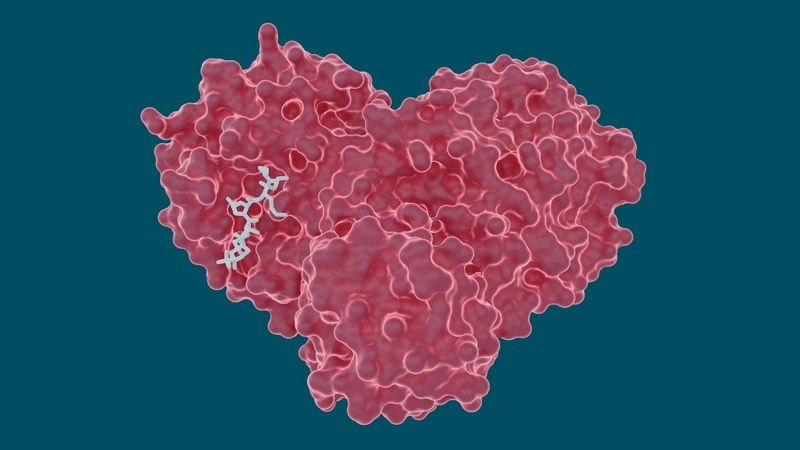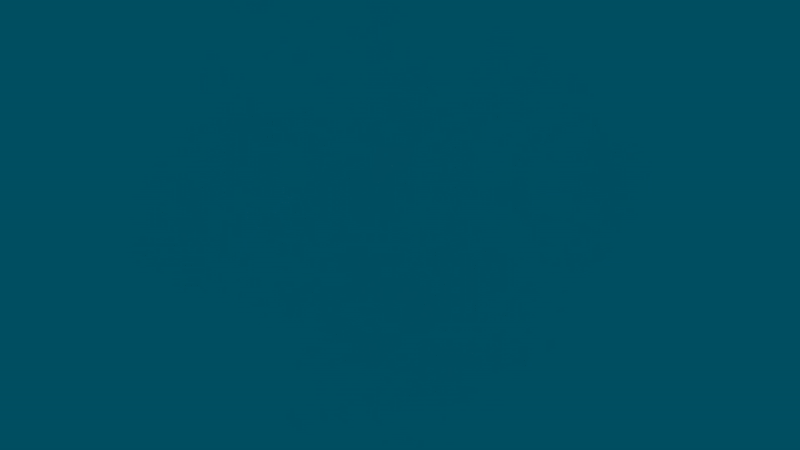
Los experimentos arrojaron resultados prometedores para ciertos medicamentos contra la hepatitis C en su capacidad para unirse e inhibir la proteasa principal del SARS-CoV-2, particularmente boceprevir y narlaprevir. La leupeptina mostró una baja afinidad de unión y se descartó como un candidato viable.
Para comprender mejor qué tan bien o con qué fuerza se unen los inhibidores a la proteasa, utilizaron cinética enzimática in vitro, una técnica que permite a los investigadores estudiar la proteasa y el inhibidor en un tubo de ensayo para medir la afinidad de unión del inhibidor, o compatibilidad, con el proteasa. Cuanto mayor sea la afinidad de unión, más eficaz será el inhibidor para bloquear el funcionamiento de la proteasa.
«Lo que estamos haciendo es sentar las bases moleculares de estos posibles inhibidores de reutilización de fármacos al revelar su modo de acción», dijo el autor correspondiente de ORNL, Andrey Kovalevsky. «Mostramos a nivel molecular cómo se unen, dónde se unen y qué están haciendo con la forma de la enzima. Y, con la cinética in vitro, también sabemos qué tan bien se unen. Cada pieza de información nos acerca un paso más a darse cuenta de cómo detener el virus «.
El estudio también arroja luz sobre un comportamiento peculiar de la capacidad de la proteasa para cambiar o adaptar su forma de acuerdo con el tamaño y la estructura de la molécula inhibidora a la que se une. Las cavidades dentro de la proteasa donde se adheriría una molécula de fármaco son altamente maleables o flexibles, y pueden abrirse o cerrarse hasta cierto punto dependiendo del tamaño de las moléculas de fármaco.
Antes de que se publicara el artículo, los investigadores pusieron sus datos a disposición del público para informar y ayudar a las comunidades científica y médica. Se necesita más investigación, incluidos ensayos clínicos, para validar la eficacia y seguridad de los medicamentos como tratamiento de COVID-19.
«La investigación sugiere que vale la pena pensar en los inhibidores de la hepatitis C como posibles candidatos de reutilización. La publicación inmediata de nuestros datos permite a la comunidad científica comenzar a observar las interacciones entre estos inhibidores y la proteasa», dijo el autor correspondiente de ORNL, Leighton Coates. «No se puede diseñar un fármaco sin saber cómo funciona a nivel molecular , y los datos que proporcionamos son exactamente lo que los desarrolladores necesitan para diseñar fármacos más fuertes y de unión más estrecha para tratamientos más eficaces».