
Los científicos están empezando a descubrir cómo el microbioma intestinal puede afectar la salud del cerebro. Eso podría conducir a tratamientos mejores y más fáciles para las enfermedades cerebrales.

Cassandra Willyard
En 2006, poco después de que lanzara su propio laboratorio, la neurocientífica Jane Foster descubrió algo que estaba segura de que pondría en marcha su campo. Ella y su equipo estaban trabajando con dos grupos de ratones: uno con una selección saludable de microorganismos en sus intestinos y otro que carecía de microbioma. Notaron que los ratones sin bacterias intestinales parecían menos ansiosos que sus equivalentes saludables. Cuando se colocó en un laberinto con algunos caminos abiertos y algunos amurallados, prefirieron los caminos expuestos. Las bacterias en el intestino parecían estar influyendo en su cerebro y comportamiento.
Foster, de la Universidad McMaster en Hamilton, Canadá, redactó el estudio y lo envió para su publicación. Fue rechazado. Lo reescribió y lo envió de nuevo. Rechazado. “La gente no se lo tragó. Pensaron que era un artefacto ”, dice. Finalmente, después de tres años y siete presentaciones, recibió una carta de aceptación 1 .
John Cryan, neurocientífico del University College Cork en Irlanda, se unió al campo casi al mismo tiempo que Foster, y sabe exactamente cómo se sentía. Cuando comenzó a hablar sobre las conexiones entre las bacterias que viven en el intestino y el cerebro, “me sentí muy evangélico”, dice. Recuerda una conferencia sobre la enfermedad de Alzheimer en la que presentó en 2014. “Nunca he dado una charla en una sala donde haya menos interés”.
Hoy, sin embargo, el eje intestino-cerebro es una característica de las principales reuniones de neurociencia, y Cryan dice que ya no es “este loco de Irlanda”. Miles de publicaciones durante la última década han revelado que los billones de bacterias en el intestino podrían tener efectos profundos en el cerebro y podrían estar vinculados a una gran cantidad de trastornos. Financiadores como los Institutos Nacionales de Salud de EE. UU. Están invirtiendo millones de dólares para explorar la conexión.
Pero junto con esa explosión de interés ha llegado la exageración. Algunos investigadores del intestino-cerebro afirman o insinúan relaciones causales cuando muchos estudios solo muestran correlaciones, y algunas inestables, dice Maureen O’Malley, filósofa de la Universidad de Sydney en Australia que estudia el campo de la investigación del microbioma. «¿Ha encontrado una causa real o ha encontrado simplemente otro efecto?»
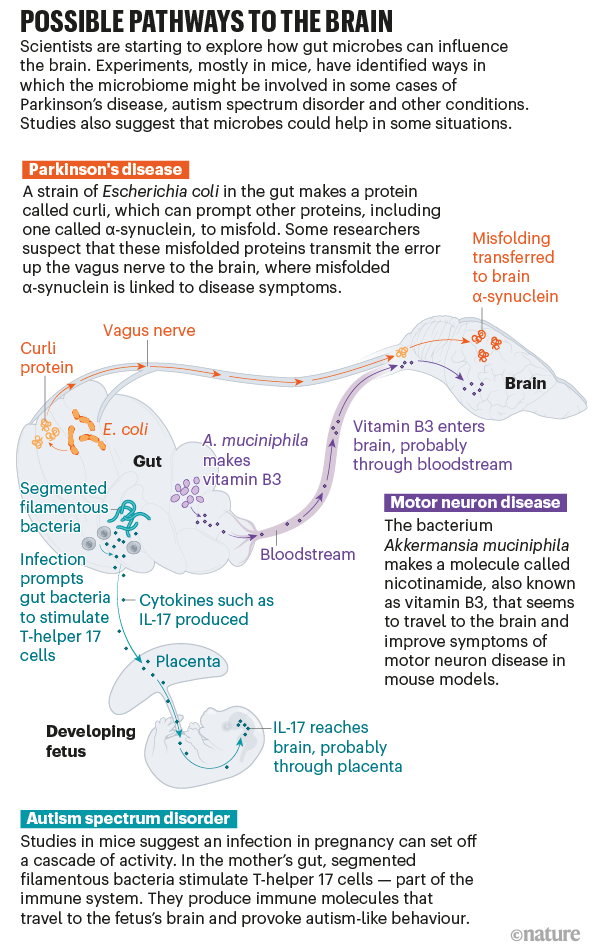
En los últimos años, sin embargo, el campo ha logrado avances significativos, dice O’Malley. En lugar de hablar del microbioma en su conjunto, algunos equipos de investigación han comenzado a profundizar para identificar microbios específicos, trazando un mapa de las vías complejas y, a veces, sorprendentes que los conectan con el cerebro. “Eso es lo que permite que se hagan atribuciones causales”, dice. Los estudios en ratones, y el trabajo preliminar en humanos, sugieren que los microbios pueden desencadenar o alterar el curso de afecciones como la enfermedad de Parkinson, el trastorno del espectro autista y más (consulte ‘Posibles vías hacia el cerebro’). Las terapias destinadas a modificar el microbioma podrían ayudar a prevenir o tratar estas enfermedades, una idea que algunos investigadores y empresas ya están probando en ensayos clínicos en humanos.
Es los primeros días, pero la perspectiva de nuevas terapias para algunas de estas enfermedades cerebrales intratables es emocionante, dice Sarkis Mazmanian, microbiólogo del Instituto de Tecnología de California en Pasadena, particularmente dado que es mucho más fácil manipular el intestino que el cerebro. . Llevar terapias al cerebro ha sido un desafío de larga data, dice, «pero seguro que puedes cambiar el microbioma».
Transmisión enredadera
En 1817, el cirujano inglés James Parkinson describió algunos de los primeros casos de «parálisis temblorosa» que se conocería como enfermedad de Parkinson. Un individuo había desarrollado entumecimiento y sensación de hormigueo en ambos brazos. Parkinson notó que el abdomen del hombre parecía contener una «acumulación considerable». Dosificó al hombre con un laxante y diez días después sus intestinos estaban vacíos y sus síntomas habían desaparecido.
Parkinson podría haber estado en algo. Algunas personas que desarrollan la enfermedad experimentan estreñimiento mucho antes de desarrollar problemas de movilidad. Y muchos investigadores han abrazado la idea de que la enfermedad comienza en el intestino, al menos en algunos casos.
Para entender la idea, es útil saber un poco sobre la enfermedad. Los síntomas característicos del Parkinson (temblores, rigidez y lentitud de movimiento) aparecen cuando las neuronas responsables de coordinar el movimiento comienzan a morir. No se comprende completamente por qué mueren estas neuronas, pero una proteína conocida como α-sinucleína parece tener un papel clave. En personas con enfermedad de Parkinson, la proteína se pliega incorrectamente. La primera proteína mal plegada hace que más se doblen mal, hasta que comienzan a formarse en el cerebro grupos dañinos conocidos como cuerpos de Lewy.
¿Qué desencadena esta cascada? En 2015, Robert Friedland, neurólogo de la Universidad de Louisville en Kentucky, propuso una nueva teoría. Había leído que las bacterias intestinales pueden producir proteínas que tienen una estructura similar a las proteínas α-sinucleína deformadas, por lo que postuló que las proteínas bacterianas podrían estar proporcionando una plantilla para el plegado incorrecto 2 . Y cuando él y sus colegas alimentaron a ratas con una cepa particular de Escherichia coli que produce una de estas proteínas aglutinantes, llamada curli, en el intestino, vieron más acumulación de α-sinucleína en el cerebro de los animales 3 . El trabajo publicado el año pasado por Mazmanian y su equipo respalda la teoría 4 de Friedland .
Aún no está claro cómo esa señal en el intestino llega al cerebro, pero un conducto probable es el nervio vago. El vago conecta el tronco encefálico con muchos órganos, incluido el colon, lo que lo convierte en el más largo de los doce nervios craneales que transportan señales entre el cerebro y el resto del cuerpo. “Es realmente una autopista”, dice Cryan. Y la investigación en humanos y animales sugiere que tiene un papel crucial en transportar al menos algunos mensajes entre el intestino y el cerebro.
En la década de 1970, una terapia común para las úlceras de estómago era extirpar todo o parte del nervio para frenar la producción de ácido en el estómago. Pero en las últimas décadas, los investigadores notaron un efecto secundario extraño: las personas que se habían sometido a este procedimiento parecían ser menos susceptibles a la enfermedad de Parkinson 5 .
En un estudio en ratones, la inyección de α-sinucleína mal plegada en el intestino la produjo en el cerebro. Pero si los investigadores primero extirparon el nervio vago, no apareció α-sinucleína en el cerebro 6 . La α-sinucleína inyectada en sí parece permanecer en el intestino, pero Valina Dawson, neurocientífica de la Universidad Johns Hopkins en Baltimore, Maryland, autora del estudio, cree que podría haber un efecto dominó: las proteínas mal plegadas transmiten el error. el nervio vago hasta que las proteínas del cerebro finalmente se pliegan mal. Mazmanian y sus colegas ahora están llevando a cabo experimentos para ver si la proteína curli en el intestino aún puede provocar síntomas de Parkinson en ratones a los que se les cortó el nervio vago.
Debido a que las proteínas mal plegadas son un sello distintivo de varias otras afecciones que afectan el cerebro, incluida la enfermedad de Alzheimer y la enfermedad de las neuronas motoras (esclerosis lateral amiotrófica o ELA), Friedland dice que las proteínas bacterianas también podrían estar implicadas en estas enfermedades. Dawson encuentra plausible la idea, pero dice que los amiloides bacterianos no son el único factor a considerar. El Parkinson, por ejemplo, es una enfermedad compleja que se presenta de manera diferente en diferentes personas. Aún así, dice, «esta podría ser una forma de comenzar».
Acelerando el declive
Los defensores del vínculo intestino-cerebro dicen que el microbioma podría hacer más que simplemente desencadenar algunos casos de enfermedad neurodegenerativa: también podría tener efectos sobre su gravedad. Eran Elinav, inmunólogo del Instituto de Ciencias Weizmann en Rehovot, Israel, y del Centro Alemán de Investigación del Cáncer en Heidelberg, se sorprendió por las diferencias en cómo se puede desarrollar la ELA: algunas personas con la enfermedad progresan lentamente y otras se deterioran rápidamente. Elinav se preguntó si el microbioma ayuda a explicar esas diferencias, por lo que él y su equipo comenzaron a trabajar con uno de los modelos de ratón con ELA más comunes. Cuando eliminaron el microbioma con antibióticos o utilizaron ratones que carecían de un microbioma desde el nacimiento, vieron una progresión de la enfermedad mucho más rápida que en los ratones con un microbioma 7 normal .
El equipo comparó las bacterias intestinales en ratones con ELA con las de sus compañeros de camada sanos y encontró varias especies microbianas que parecían estar relacionadas con la enfermedad. Trasplantaron minuciosamente esas especies, una por una, a otro grupo de ratones sin bacterias intestinales, identificando dos especies que empeoraban los síntomas de ELA y una que parecía mejorarlos. “Y luego nos preguntamos, ‘¿cómo es que esta cepa que solo vive en el intestino impacta de manera tan asombrosa en una enfermedad que se concentra en el cerebro?’”, Dice Elinav.
Los culpables podrían ser los metabolitos bacterianos, pequeñas moléculas producidas por bacterias que pueden ingresar al torrente sanguíneo y viajar por el cuerpo. Al menos la mitad de todas las moléculas pequeñas en la sangre son “producidas por microbios o moduladas por microbios”, dice Elinav. Él y su equipo analizaron los metabolitos producidos por el microbio beneficioso y administraron uno, una molécula llamada nicotinamida, también conocida como vitamina B3, a ratones propensos a la ELA. Descubrieron que la molécula ingresó al cerebro y mejoró sus síntomas 7 . “Podríamos probar que hay una bacteria, podríamos probar que hay un producto de la bacteria y podríamos probar que nadaba hacia el órgano diana correcto y estaba haciendo algo favorable al curso de la enfermedad”, dice.
Cuando compararon los microbiomas de las personas con ELA y los de sus familiares no afectados, vieron menos nicotinamida en los individuos con ELA 7 . El metabolito está disponible como suplemento y Elinav dice que él y sus colegas están planeando un ensayo clínico con él.
Al menos un grupo ya ha probado la vitamina B3 como tratamiento para la ELA en un pequeño ensayo, aunque una versión combinada con otro compuesto. Lo administraron a participantes con ELA durante cuatro meses. Aquellos en el grupo de tratamiento mostraron alguna mejoría, pero casi todas las personas en el grupo de placebo declinaron en salud 8 .
“Esto es solo el comienzo”, dice Elinav. Existen muchas más bacterias y metabolitos, y cada célula del cuerpo está abierta a sus efectos. Una vez que te das cuenta de eso, dice, «comienzas a comprender que el efecto del microbioma podría expandirse mucho más allá de donde realmente viven los microbios».
Efectos generacionales
El efecto podría incluso pasar de una generación a la siguiente. Tomemos como ejemplo el trastorno del espectro autista (TEA). Las causas aún se conocen poco, pero las infecciones en una madre durante el embarazo parecen aumentar el riesgo de TEA en su hijo, según estudios epidemiológicos. Por ejemplo, en una cohorte sueca de casi 1,8 millones de personas, aquellas cuyas madres habían sido hospitalizadas por cualquier infección durante el embarazo tenían un riesgo 79% mayor de ser diagnosticadas con TEA 9 .
La investigación en ratones también apoya el vínculo. Para imitar una infección, los investigadores inyectan a las ratones embarazadas ARN de doble hebra, que el cuerpo ve como un invasor viral. Sus cachorros exhiben comportamientos más repetitivos y ansiedad que los nacidos de madres que no fueron inyectadas e interactúan menos con otros ratones, síntomas que reflejan los de las personas con TEA 10 .
Gloria Choi, neurocientífica del Instituto Picower para el Aprendizaje y la Memoria del Instituto de Tecnología de Massachusetts en Cambridge, y su esposo y colaborador Jun Huh, inmunólogo de la Escuela de Medicina de Harvard en Boston, querían saber por qué. Se concentraron en un tipo de célula que se defiende contra bacterias y hongos mediante la producción de moléculas llamadas citocinas. Cuando Choi y Huh imitaron una infección en sus ratones, estas células, llamadas células T-helper 17, se volvieron hiperactivas, produciendo un tipo particular de citocina llamada IL-17. Esta molécula viajó al cerebro de los cachorros en desarrollo, probablemente a través de la placenta, y luego se unió a los receptores cerebrales. Esto pareció tener un efecto profundo en los animales: los investigadores encontraron que la descendencia adulta mostraba una mayor actividad neuronal, lo que provocaba comportamientos parecidos al autismo.11 .
Pero “no todas las mujeres embarazadas que están infectadas u hospitalizadas durante el embarazo necesariamente tienen hijos con trastornos del desarrollo neurológico o autismo”, dice Huh. Debe haber algo que incline el sistema inmunológico de la madre hacia este estado hiperactivo. Choi y Huh se centraron en una colección de microbios intestinales largos y delgados conocidos como bacterias filamentosas segmentadas, que previamente se había demostrado que promueven la formación de células T-helper 17. Cuando trataron a ratones embarazadas con un antibiótico para matar estas bacterias y luego estimularon una respuesta inmune, los cachorros no desarrollaron ninguna diferencia de comportamiento 12 .
Choi y Huh, ansiosos por saber si la pandemia de coronavirus podría conducir a un mayor riesgo de TEA, están recolectando muestras de mujeres embarazadas que están infectadas con SARS-CoV-2 y catalogando las bacterias en sus intestinos y los niveles de IL-17 en sus sangre. Dado que el coronavirus, como cualquier otra infección, activa el sistema inmunológico de la madre, es plausible que el SARS-CoV-2 pueda aumentar el riesgo de desarrollo cerebral alterado y trastornos potencialmente psiquiátricos, dice David Amaral, quien estudia TEA en la Universidad de California. , Davis. Los investigadores aún no han encontrado evidencia que apoye esta teoría.
Mauro Costa-Mattioli, neurobiólogo del Baylor College of Medicine en Houston, Texas, también está estudiando la relación entre las bacterias y los TEA. Pero en lugar de observar los microbios que causan el trastorno, ha encontrado uno que podría tratar sus síntomas.
Costa-Mattioli tropezó con esta bacteria por accidente hace unos cinco años. En ese momento, estaba trabajando con ratones con crías que tenían síntomas similares al autismo. Cuando esos ratones se alojaron con neurotípicos (y se comieron sus excrementos, como suelen hacer todos los ratones), sus comportamientos similares a los de TEA desaparecieron. Costa-Mattioli y sus colegas descubrieron que a los ratones afectados les faltaba una especie particular de bacteria: Lactobacillus reuteri .
Probaron L. reuteri en varios otros modelos de ratones, y la bacteria fue capaz de revertir algunos de los comportamientos similares al TEA en todos. Y, al igual que con el trabajo de Parkinson, los investigadores podrían bloquear el efecto en ratones si cortan el nervio vago 13 .
Aún no se sabe exactamente qué tipo de señal envía L. reuteri . El equipo ha descubierto que algunas cepas de L. reuteri pueden revertir los comportamientos mientras que otras no, y los investigadores ahora están trabajando para descubrir cuáles de sus genes están involucrados. Si encuentran el gen que produce un metabolito clave, «podemos ponerlo en cualquier bacteria y ahora podemos tener un tratamiento potencial», dice Costa-Mattioli. Esa estrategia aún no se ha probado.
Un grupo en Italia ya está probando L. reuteri como terapia en 80 niños con TEA . Los participantes tomarán L. reuteri o una tableta de placebo durante seis meses y se controlarán sus síntomas. Costa-Mattioli espera lanzar pronto su propia prueba.
Queda por ver si funcionará, pero Kevin Mitchell, neurogenetista del Trinity College de Dublín, aún no encuentra convincentes los estudios con ratones. Y ve la discusión sobre el potencial terapéutico como prematura y “un poco irresponsable”, dice, dada la complejidad de la condición.
Mientras tanto, los investigadores están explorando más enfermedades cerebrales, incluidas la enfermedad de Alzheimer y la depresión. Los microbios intestinales incluso podrían influir en la forma en que el cerebro se recupera después de una lesión. Corinne Benakis, neurobióloga del Instituto de Investigación de Accidentes Cerebrovasculares y Demencia de la Universidad Ludwig Maximilians de Múnich en Alemania, y sus colegas trataron ratones con antibióticos para eliminar algunas de sus bacterias intestinales antes de inducir un accidente cerebrovascular. Descubrieron que los antibióticos podrían reducir la gravedad del daño cerebral 14 .
En cada una de estas enfermedades, quedan muchas preguntas mecanicistas. Los investigadores en el campo reconocen que todavía tienen que desarrollar las vías del microbio al cerebro. Y el paso más complicado será validar estos hallazgos animales en humanos y pasar a los ensayos. «Estas son afirmaciones extraordinarias, que deberían requerir pruebas extraordinarias», dice Mitchell.
Pero también hay un enorme interés, y no solo de los académicos. En febrero de 2019, Axial Therapeutics en Waltham, Massachusetts, una compañía cofundada por Mazmanian para desarrollar terapias para enfermedades neurodegenerativas y neuropsiquiátricas, recaudó US $ 25 millones en financiamiento. Otra empresa, Finch Therapeutics en Somerville, Massachusetts, que está desarrollando un fármaco de microbioma oral para el TEA, anunció en septiembre que había recaudado 90 millones de dólares.
Cryan ha observado la acumulación de datos desde que su charla sobre el tema fue recibida con un silencio sepulcral. Encuentra convincentes las pruebas acumuladas y ve una enorme promesa en las terapias basadas en microbiomas. “A diferencia de tu genoma, sobre el cual no puedes hacer mucho más que culpar a tus padres y abuelos, tu microbioma es potencialmente modificable. Y eso brinda una gran agencia a los pacientes ”, dice. «Eso es realmente emocionante».
Nature 590 , 22-25 (2021)
doi: https://doi.org/10.1038/d41586-021-00260-3
ACTUALIZACIONES Y CORRECCIONES
- Corrección 8 de febrero de 2021 : una versión anterior de esta función ubicó erróneamente a la Universidad McMaster en Toronto.
Referencias
- 1.Neufeld, KM, Kang, N., Bienenstock, J. y Foster, JA Neurogastroenterol. Motil. 23 , 255 – e119 (2011).PubMed Artículo Google Académico
- 2.Friedland, RP J. Alzheimer’s Dis. 45 , 349–362 (2015).Artículo Google Académico
- 3.Chen, SG y col. Sci. Rep. 6 , 34477 (2016).PubMed Artículo Google Académico
- 4.Sampson, TR y col. eLife 9 , e53111 (2020).PubMed Artículo Google Académico
- 5.Svensson, E. et al. Ana. Neurol. 78 , 522–529 (2015).PubMed Artículo Google Académico
- 6.Kim, S. y col. Neuron 103 , 627–641 (2019).PubMed Artículo Google Académico
- 7.Blacher, E. et al. Nature 572 , 474–480 (2019).PubMed Artículo Google Académico
- 8.de la Rubia, JE et al. Amiotrofo. Scler lateral. Frontotemp. Degen. 20 , 115-122 (2019).Artículo Google Académico
- 9.al-Haddad, BJS et al. JAMA Psychiatry 76 , 594–602 (2019).PubMed Artículo Google Académico
- 10.Careaga, M., Murai, T. y Bauman, MD Biol. Psiquiatría 81 , 391–401 (2017).PubMed Artículo Google Académico
- 11.Yim, YS y col. Nature 549 , 482–487 (2017).PubMed Artículo Google Académico
- 12.Kim, S. y col. Nature 549 , 528–532 (2017).PubMed Artículo Google Académico
- 13.Sgritta, M. y col. Neuron 101 , 246-259 (2019).PubMed Artículo Google Académico
- 14.Benakis, C. y col. Nature Med. 22 , 516–523 (2016).PubMed Artículo Google Académico
