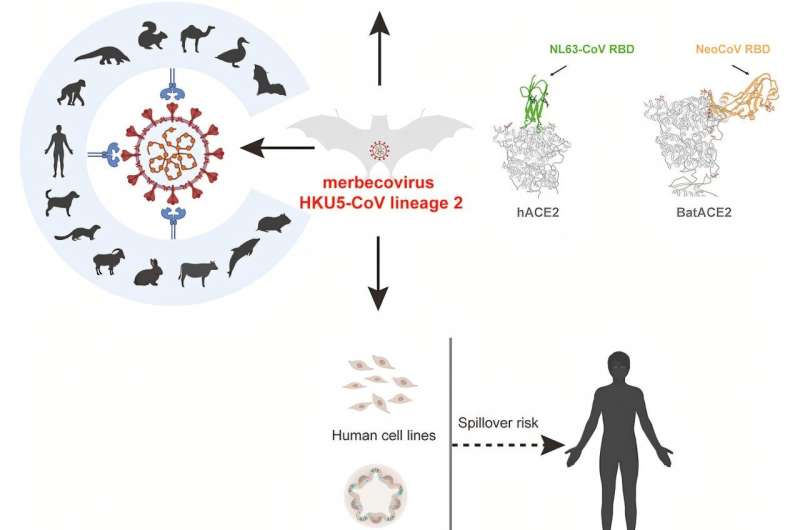
Una investigación dirigida por el Instituto de Virología de Wuhan ha identificado un linaje de virus de murciélagos distinto capaz de infectar células humanas utilizando el receptor ACE2. El merbecovirus recién descubierto, denominado HKU5-CoV-2, fue aislado de murciélagos Pipistrellus recolectados en la provincia de Guangdong, China.
Por Justin Jackson, Medical Xpress
En pruebas de laboratorio, el virus demuestra amplias afinidades con huéspedes de varias especies de mamíferos, aunque nunca se ha reportado evidencia de transmisión humana.
Los murciélagos pipistrelle se encuentran en todo el mundo, desde el oeste americano hasta el sur de Europa y Asia, y son los murciélagos más comunes en todo el Reino Unido. Estos pequeños mamíferos nocturnos, tan pequeños que caben en el zapato de un niño, se alimentan principalmente de insectos voladores como mosquitos y polillas.
Los merbecovirus, un subgénero de betacoronavirus, incluyen el MERS-CoV y varios coronavirus derivados de murciélagos. Históricamente, estos virus utilizan principalmente el receptor DPP4 para ingresar a las células.
El análisis reveló que el HKU5-CoV-2 utiliza el ACE2 humano, un receptor que normalmente utilizan el SARS-CoV, el SARS-CoV-2 y el HCoV-NL63. Investigaciones anteriores sobre el linaje 1 del HKU5-CoV mostraron una capacidad limitada para utilizar el ACE2 humano. El uso de este receptor por parte del HKU5-CoV-2 plantea inquietudes sobre la posible transmisión entre animales y humanos.
En el estudio, «Bat-infecting merbecovirus HKU5-CoV lineage 2 can use human ACE2 as a cell entry receptor», publicado en Cell , el equipo detalla la identificación del virus, el análisis estructural y los mecanismos de infección. Los investigadores analizaron muestras de hisopado anal de Pipistrelle mediante PCR de pan-coronavirus y secuenciaron seis cepas de HKU5-CoV.
El análisis filogenético clasificó estos virus en un linaje distinto (linaje 2). La cepa representativa BtHKU5-CoV-2-441 compartía un 78,8%–78,9% de similitud genómica con la cepa prototipo HKU5. Las diferencias estructurales en el dominio de unión al receptor (RBD) diferenciaban al HKU5-CoV-2 de los virus del linaje 1.
La criomicroscopía electrónica reveló que el HKU5-CoV-2 se une a la ECA2 humana a través de un patrón de interacción único. El análisis de mutagénesis mostró que las mutaciones puntuales en el RBD afectaron mínimamente la unión, lo que indica que el RBD del virus puede tolerar mutaciones sin afectar significativamente la unión a la ECA2. Los ensayos funcionales confirmaron la capacidad del HKU5-CoV-2 de infectar células humanas que expresan la ECA2.
El virus aislado BtHKU5-CoV-2-023 infectó a organoides respiratorios y entéricos humanos, con títulos virales que aumentaron hasta en 2 unidades logarítmicas. No hubo infección en células con inactivación de ACE2 y se restableció tras la reintroducción de ACE2.
Los ensayos de dependencia de proteasas indicaron que tanto TMPRSS2 como la catepsina L facilitan la entrada viral. Los sitios de escisión S1/S2 y S2 de la proteína de la espícula fueron cruciales para la fusión de la membrana, aunque su eficiencia de escisión fue menor que la del MERS-CoV. El tratamiento con tripsina mejoró la entrada viral y la escisión de la proteína S.
Se evaluaron posibles intervenciones terapéuticas. Los anticuerpos monoclonales dirigidos a la subunidad S2 y el inhibidor de fusión EK1C4 inhibieron la entrada viral. Las moléculas pequeñas nirmatrelvir, remdesivir y GC376 suprimieron la replicación viral en cultivos celulares. A diferencia de los anticuerpos dirigidos a la subunidad S2, los anticuerpos dirigidos al SARS-CoV-2 no neutralizaron eficazmente el HKU5-CoV-2.
A pesar de la afinidad de HKU5-CoV-2 por la ECA2 y su amplio espectro de hospedadores potenciales, su menor afinidad de unión y la escisión subóptima de la proteína S reducen el riesgo inmediato de contagio entre humanos. Si bien no es una amenaza inmediata, el potencial mutacional del virus para la transmisión entre especies y su capacidad de adaptación justifican una vigilancia continua.
No se realizaron estudios in vivo en animales para probar la patogenicidad y transmisibilidad en un huésped vivo.
Más información: Jing Chen et al., El linaje 2 del merbecovirus HKU5-CoV que infecta murciélagos puede utilizar la ECA2 humana como receptor de entrada celular, Cell (2025). DOI: 10.1016/j.cell.2025.01.042
Nota editorial:
Este artículo ha sido elaborado con fines divulgativos a partir de información pública y fuentes especializadas, adaptado al enfoque editorial del medio para facilitar su comprensión y contextualización.
