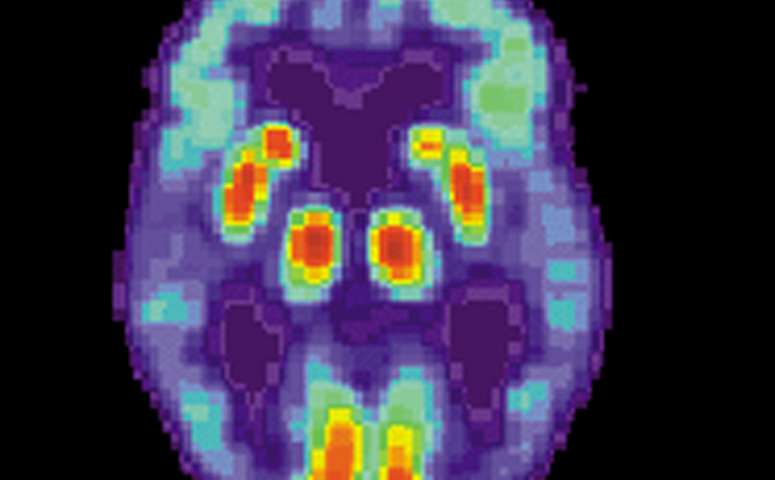
Se trata del principio activo que ataca los depósitos de una proteína llamada beta-amiloide. El medicamento frenó de forma moderada el declive de las funciones cognitivas en un 27%, según un ensayo clínico. Todos los detalles

La ciencia le da pelea constante al Alzheimer, una enfermedad compleja que afecta a millones de personas en todo el mundo. La esperanza de vida sigue aumentando, como tambiénse incrementa la cantidad de personas que viven con Alzheimer, la forma más común de demencia en personas mayores de 65 años.
A nivel global, más de 55 millones de personas (el 8,1% de las mujeres y el 5,4% de los hombres mayores de 65 años) viven con enfermedades mentales, según datos de la Organización Mundial de la Salud (OMS). Además, se estima que esta cifra aumentará a 78 millones para 2030 y a 139 millones para 2050.
La enfermedad de Alzheimer es un trastorno neurológico que provoca la atrofia cerebral, genera la muerte progresiva de las neuronas, lo que promueveel deterioro continuo en el pensamiento, el comportamiento y las habilidades sociales que afecta la capacidad de una persona para vivir de forma independiente.
Ahora, la Administración de Alimentos y Medicamentos de Estados Unidos (FDA) aprobó el lecanemab, un fármaco contra el Alzheimer para pacientes en las primeras fases de la enfermedad. El fármaco pertenece a una clase de tratamientos que pretenden ralentizar el avance de la enfermedad neurodegenerativa eliminando del cerebro los grumos pegajosos de la proteína tóxica beta amiloide.
 El ensayo incluyó a casi 1.800 pacientes con deterioro cognitivo leve causado por la enfermedad de Alzheimer o la enfermedad de Alzheimer en etapa temprana (Getty Images)
El ensayo incluyó a casi 1.800 pacientes con deterioro cognitivo leve causado por la enfermedad de Alzheimer o la enfermedad de Alzheimer en etapa temprana (Getty Images)
Casi todos los fármacos experimentales anteriores que usaban el mismo enfoque habían fracasado. Este fármaco está destinado a pacientes con deterioro cognitivo leve o demencia precoz de Alzheimer, una población que, según los médicos, representa un pequeño grupo de los aproximadamente 6 millones de estadounidenses que padecen actualmente la enfermedad que destruye la memoria.
El medicamento, llamado lecanemab, fue aprobado en el marco del proceso de revisión acelerada de la FDA, que apura su acceso en función de su impacto en los biomarcadores relacionados con la enfermedad subyacente que se cree que predicen un beneficio clínico.
Los expertos en Alzheimer dijeron que el fármaco ofrecebeneficios modestospara los pacientes con deterioro cognitivo leve o Alzheimer en etapa temprana. Y que también conlleva algunos riesgos de hinchazón y sangrado en el cerebro que requerirán monitoreo. Sin embargo la enfermedad de Alzheimer no ha visto un progreso como este en décadas, por lo que, incluso -indicaron- con limitaciones, la droga es innovadora y una razón para un optimismo cauteloso.
 Los fabricantes del medicamento dijeron en un comunicado que la desaceleración del deterioro, en comparación con un placebo, fue “altamente significativa desde el punto de vista estadístico” (Getty)
Los fabricantes del medicamento dijeron en un comunicado que la desaceleración del deterioro, en comparación con un placebo, fue “altamente significativa desde el punto de vista estadístico” (Getty)
“He hecho este diagnóstico miles de veces. He tomado muchas manos y he pasado muchos Kleenex”, dijo Jo Cleveland, médica y profesora especializada en medicina geriátrica en Wake Forest Baptist Health. La nueva aprobación “se siente como el comienzo de algo importante, como si ahora pudiéramos tomar impulso”.
Aunque no es una cura para el Alzhéimer, el gran ensayo clínico publicado en noviembre mostró que el tratamiento ralentiza el deterioro cognitivo y funcional de los pacientes con alzhéimer en etapa temprana en un 27 % en comparación con el placebo. En el estudio de 18 meses, el fármaco también redujo drásticamente los niveles de beta-amiloide, una proteína tóxica en el cerebro que se cree que impulsa el avance de la enfermedad de Alzheimer.
“La enfermedad de Alzheimer incapacita inmensamente la vida de quienes la padecen y tiene efectos devastadores en sus seres queridos”, dijo Billy Dunn, director de la Oficina de Neurociencia del Centro de Evaluación e Investigación de Medicamentos de la FDA. “Esta opción de tratamiento es la última terapia para atacar y afectar el proceso subyacente de la enfermedad de Alzheimer, en lugar de solo tratar los síntomas de la enfermedad”.
Biogen, la empresa de biotecnología con sede en Cambridge, Massachusetts, comercializará conjuntamente el fármaco con la farmacéutica japonesa Eisai, quien restringió el estudio a personas con deterioro cognitivo leve o Alzheimer en etapa temprana que también tienen evidencia de acumulación de amiloide en el cerebro, confirmada por una exploración de imágenes.
 Las empresas ya solicitaron a la FDA la aprobación acelerada de lecanemab, según datos de etapas anteriores (Getty Images)
Las empresas ya solicitaron a la FDA la aprobación acelerada de lecanemab, según datos de etapas anteriores (Getty Images)
Las compañías dijeron que los participantes del ensayo clínico fueron evaluados en varias áreas para medir el ritmo de su declive, incluida la memoria, la orientación y la resolución de problemas. A partir de los seis meses, el grupo que recibió el tratamiento mostró mejoras respecto del grupo de placebo. El tratamiento se administró por vía intravenosa dos veces al mes.
Desde Eisai también sostuvieron que los resultados mostraron que la “hipótesis amiloide”, que sostiene que la eliminación de las placas amiloides puede retrasar la progresión de la enfermedad neurodegenerativa, es válida.
La etiqueta aprobada por la FDA refleja la misma población reducida de pacientes, estimada en aproximadamente 1 millón de personas en los EE. UU., o poco menos del 20 % que vive actualmente con un diagnóstico de Alzheimer. La etiqueta también exige que los pacientes se sometan a tres escáneres cerebrales adicionales durante las primeras 14 semanas de tratamiento como medida de precaución para monitorear episodios potencialmente graves de inflamación o sangrado cerebral.
Aunque la mayoría de las ocurrencias de este efecto secundario común, llamado ARIA, se pueden manejar sin complicaciones, se amplifica en personas que toman anticoagulantes concomitantes para prevenir coágulos, y se ha asociado con al menos dos muertes. Esta semana se publicó un estudio del caso que detalla la muerte del segundo paciente en el New England Journal of Medicine. Eisai ha dicho que la tasa de ARIA informada en sus estudios es baja y que los monitores de seguridad independientes no han planteado ninguna preocupación.
 (Foto: Biogen)
(Foto: Biogen)
Estas noticias alentadoras contrastan con el lanzamiento poco exitoso el año pasado de otro medicamento, comercializado como Aduhelm, patrocinado por las dos compañías. Al igual que Aduhelm, lecanemab reduce las acumulaciones anormales de beta amiloide, un sello distintivo de la enfermedad de Alzheimer.
Qué dicen de los expertos
Luca Giliberto, neurólogo y profesor de los Institutos Feinstein de Investigación Médica de Northwell Health en Long Island, Nueva York, sostuvo que es probable que el comité directivo de demencia de su institución respalde el uso de Leqembi, pero con pautas de detección conservadoras que excluyen a las personas con riesgo de sangrado o con la presencia de microhemorragias.
“Creo que hay un subconjunto de pacientes que se beneficiarán del fármaco. El tamaño del efecto es mínimo y puede no ser perceptible para los pacientes o cuidadores durante los 18 meses que se muestran en el ensayo. Pero si continúa el tratamiento el tiempo suficiente, dos años o más, tal vez la diferencia mejore”, dijo.
 Los expertos respaldan el uso de Leqembi, pero con pautas de detección conservadoras que excluyen a las personas con riesgo de sangrado o con la presencia de microhemorragias
Los expertos respaldan el uso de Leqembi, pero con pautas de detección conservadoras que excluyen a las personas con riesgo de sangrado o con la presencia de microhemorragias
Madhav Thambisetty, neurólogo y profesor adjunto de neurología en la Facultad de Medicina de la Universidad Johns Hopkins, sumó que el uso de Leqembi en el “mundo real” debería “parecerse lo más posible a los inscritos en el estudio de fase 3″.
Ian Grant, profesor asistente de neurología en la Facultad de Medicina Feinberg de la Universidad Northwestern, dijo que Leqembi tiene un “beneficio real pero marginal” que marcará una diferencia significativa para algunos de sus pacientes. Otros pueden no notar ninguna mejora.
“No quiero imponer lo que creo que es clínicamente significativo a mis pacientes y sus familias. Cualquier cosa que brinde algún beneficio, por pequeño que sea, vale la pena para algunos pacientes. Otros pueden verlo de manera diferente”, dijo.
Cleveland, el médico de Wake Forest, estima que entre el 10 % y el 15 % de las personas que acuden a su clínica para una evaluación cognitiva probablemente serían buenos candidatos para Leqembi.
Con información de Reuters y AFP
