El VIH, el virus que causa el SIDA, se ha estudiado ampliamente desde que la epidemia de SIDA fue reconocida oficialmente por profesionales de la salud a principios de los años ochenta.
Ann Manser, Universidad de Delaware
Durante ese tiempo, la investigación ha llevado al desarrollo de medicamentos antirretrovirales efectivos que en muchos casos impiden que una persona infectada con VIH desarrolle SIDA.
A pesar de ese éxito médico, alrededor de 37 millones de personas en todo el mundo, incluidos aproximadamente 2 millones de niños menores de 15 años, viven con la infección por el VIH, y cada año se producen alrededor de un millón de muertes relacionadas con el SIDA.
Y muchos aspectos del proceso en el que el virus del VIH madura y se vuelve infeccioso continúan desconcertando a los científicos.
Investigadores de la Universidad de Delaware han colaborado con científicos de la Universidad de Pittsburgh para obtener nuevos conocimientos sobre esta estructura, gracias a una gran cantidad de investigaciones recientes centradas en la cápside , una cubierta de proteína que contiene el virus.
Sus últimos hallazgos, publicados en octubre en la revista Proceedings de la Academia Nacional de Ciencias ( PNAS ), identifican algunas interacciones específicas que ocurren entre la cápside y una proteína clave que interfiere con la integridad de la cubierta protectora.
Los hallazgos son solo un paso para comprender mejor el mecanismo de la infección por VIH, pero los investigadores creen que es un avance importante.
«Esto es ciencia básica, investigación fundamental, y nunca se sabe en qué dirección nos guiará», dijo Tatyana Polenova, profesora de química y bioquímica en la UD, quien ayudó a dirigir el estudio. «Pero entender la biología estructural del VIH nos da pistas para una mejor comprensión, y esperamos que este sea un posible paso hacia el tratamiento».
El equipo de investigación utilizó una combinación de métodos de alta tecnología para estudiar la cápside y sus interacciones con una proteína llamada TRIM5-alfa, que se sabe que altera la estructura de la cápside y, por lo tanto, restringe la capacidad del virus para volverse infeccioso.
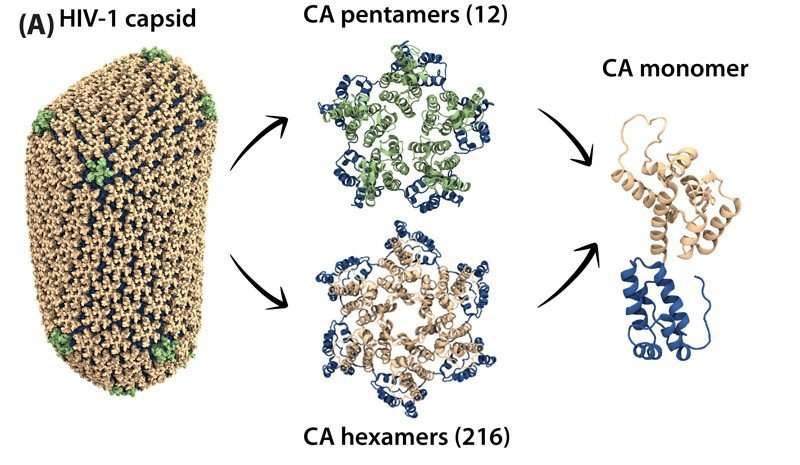
La cápside del VIH es una cubierta en forma de cono formada por proteínas de diferentes formas. En cada cápside, aproximadamente 12 de estos bloques de construcción de proteínas son pentámeros, con cinco lados, y un número variable mucho más grande son hexámeros, con seis lados.
Los bloques de construcción se unen para formar una cubierta que encierra y protege al virus hasta que es capaz de infectar células sanas. Si la estructura de la cápside se rompe prematuramente, la infección no se producirá.
«A pesar de los extensos estudios, los detalles mecánicos del ensamblaje y desensamblaje de la cápside no se conocen bien», escriben los investigadores en PNAS .
El equipo se centró en el factor de restricción TRIM5-alfa y sus interacciones con el conjunto de la cápside por varias razones. Entre ellos hay un hecho sorprendente sobre esa proteína:
«Los monos del Viejo Mundo [como los monos rhesus] tienen TRIM5-alfa, y en esos primates, detienen la infección por VIH», dijo Polenova. «Los humanos tienen la misma proteína, con algunas diferencias primarias en la secuencia de aminoácidos, pero en los humanos, no interrumpe la cápside y no detiene la infección».
En la UD, se observaron interacciones de la cápside con la proteína TRIM5-alfa con un espectrómetro de resonancia magnética nuclear (RMN), un instrumento que revela detalles sobre la estructura y el movimiento de las moléculas, con detalles a nivel atómico.
Caitlin M. Quinn, espectroscopista de RMN en el Departamento de Química y Bioquímica y el primer autor del artículo PNAS , comenzó a trabajar en estas observaciones en 2014.
Al mismo tiempo que utilizaba la RMN para observar la cápside a nivel atómico, Juan Perilla, profesor asistente de química y bioquímica en la UD (en ese momento, un científico postdoctoral en la Universidad de Illinois), estaba investigando el mismo tema. Perilla y su equipo utilizaron la supercomputadora Bridges en el Centro de Supercomputación de Pittsburgh para realizar lo que se conoce como simulaciones de dinámica molecular (MD) de todos los átomos.
Las simulaciones de MD permiten a los investigadores estudiar la forma en que se mueven las moléculas para aprender cómo desempeñan sus funciones en la naturaleza. Las simulaciones por computadora son el único método que puede revelar el movimiento de los sistemas moleculares hasta el nivel atómico y algunas veces se les conoce como el «microscopio computacional».
«Queríamos entender cómo la cápside del VIH interactúa con la proteína TRIM5-alfa», dijo Quinn. «Esa fue la pregunta más difícil de responder».
Durante años, los investigadores no habían podido observar las interacciones de la cápside con TRIM5-alfa experimentalmente, pero el equipo «le dio una oportunidad» con la espectroscopia de RMN, dijo Polenova.
«La proteína TRIM5-alfa se une al exterior de la cápside» y afecta su rigidez, dijo Quinn. «Nos sorprendió mucho descubrir que incluso en áreas de la cápside donde no interactuaba directamente, todavía había efectos en la estructura».
Los investigadores creen que la proteína utiliza varios mecanismos para desestabilizar la estructura similar a la red de la cápside y hacer que se desmonte prematuramente, mientras que la cápside en ausencia de TRIM5-alfa no se separa tan fácilmente.
La cápside en sí misma es una entidad dinámica, y los movimientos que ocurren en las moléculas constituyentes abarcan muchas escalas de tiempo de movimiento, desde picosegundos hasta segundos y más lento. Estos movimientos son críticos en la función de la cápside y se han observado independientemente en simulaciones de MD y experimentos de RMN.
El descubrimiento reciente más sorprendente es que las unidades pentamericanas y hexaméricas en la cápside parecen tener un comportamiento motriz diferente, lo que puede ser crítico en el mecanismo de desmontaje de la cápside.
«Nadie antes de nosotros pudo ver estos efectos de manera experimental, y es exactamente como lo predijeron las simulaciones de dinámica molecular», dijo Perilla, quien continúa analizando el valor de aproximadamente tres años de datos del proyecto.
Los hallazgos son una prueba más de cuán complejo y dinámico es el proceso de desarrollo e infección del VIH, dijo Polenova.
«La gente solía pensar que los virus tienen estructuras estáticas, que los [bloques de construcción] se juntaron y cerraron la cápside, y eso fue todo», dijo. «Pero no es sólido como una roca. La cápside es una entidad altamente dinámica. La proteína TRIM5-alfa la rompe, y lo hace a través de un mecanismo muy complicado, que involucra la interferencia con las propiedades motrices intrínsecas de la cápside».
El artículo «Regulación dinámica de la interacción de la cápsida del VIH-1 con el factor de restricción TRIM5α» se publicó el 17 de octubre en las Actas de la Academia Nacional de Ciencias .
Además de Quinn, Polenova y Perilla, los autores son Mingzhang Wang, Matthew P. Fritz, Brent Runge y Chaoyi Xu, todos estudiantes de doctorado en la UD, y Jinwoo Ahn y Angela M. Gronenborn del Pittsburgh Center for HIV Protein Interactions and the Departamento de Biología Estructural de la Universidad de Pittsburgh School of Medicine.
Gronenborn es Rosalind Franklin, profesora de la Facultad de Medicina de la Universidad de Pittsburgh y presidenta del Departamento de Biología Estructural. Ella es la directora del Centro de Pittsburgh financiado por los Institutos Nacionales de la Salud para las Interacciones de Proteínas del VIH, que reúne a científicos e instalaciones de alto calibre para estudiar el virus del VIH y sus interacciones con las proteínas de la célula huésped.
Más información: Caitlin M. Quinn et al. Regulación dinámica de la interacción de la cápside del VIH-1 con el factor de restricción TRIM5α identificado por RMN giratoria de ángulo mágico y simulaciones de dinámica molecular, Actas de la Academia Nacional de Ciencias (2018). DOI: 10.1073 / pnas.1800796115
Referencia del diario: Actas de la Academia Nacional de Ciencias.
Proporcionado por: University of Delaware
Leer más
- Un estudio sugiere que la calidad del semen podría indicar problemas de salud más amplios para los hombres.
- Más proteínas mal plegadas de lo que se sabía anteriormente podrían contribuir al Alzheimer y la demencia
- La radiación dirigida ofrece resultados prometedores en pacientes con cáncer de pulmón de células pequeñas con metástasis en el cerebro.
- ‘Hay demasiadas cosas sucediendo’: adultos autistas abrumados por señales sociales no verbales
- La obesidad está relacionada con lo que hay en los menús de los restaurantes locales