Los virus y las bacterias tienen una historia muy larga. Debido a que los virus no pueden reproducirse sin un huésped, han estado atacando a las bacterias durante millones de años.

por Stephen L Archer
Algunas de esas bacterias finalmente se convirtieron en mitocondrias , adaptándose sinérgicamente a la vida dentro de las células eucariotas (células que tienen un núcleo que contiene cromosomas).
En última instancia, las mitocondrias se convirtieron en las centrales eléctricas dentro de todas las células humanas .
Avance rápido hasta el surgimiento de nuevos coronavirus como el SARS-CoV-2 y la propagación global de COVID-19 . Aproximadamente el cinco por ciento de las personas infectadas con SARS-CoV-2 sufren insuficiencia respiratoria (bajo nivel de oxígeno en la sangre) que requiere hospitalización. En Canadá ha muerto alrededor del 1,1% de los pacientes infectados (casi 46.000 personas) .
Esta es la historia de cómo un equipo, reunido durante la pandemia, reconoció el mecanismo por el cual estos virus estaban causando lesiones pulmonares y reduciendo los niveles de oxígeno en los pacientes: es un retroceso a la guerra primitiva entre virus y bacterias, más específicamente, entre este nuevo virus y la descendencia evolutiva de las bacterias, nuestras mitocondrias.
El SARS-CoV-2 es el tercer nuevo coronavirus que causa brotes en humanos en el siglo XXI, después del SARS-CoV en 2003 y el MERS-CoV en 2012 . Necesitamos comprender mejor cómo los coronavirus causan lesiones pulmonares para prepararnos para la próxima pandemia.
Cómo afecta el COVID-19 a los pulmones
Las personas con neumonía grave por COVID-19 a menudo llegan al hospital con niveles de oxígeno inusualmente bajos. Tienen dos características inusuales distintas de los pacientes con otros tipos de neumonía:
- En primer lugar, sufren lesiones generalizadas en las vías respiratorias inferiores (los alvéolos, que es donde se toma el oxígeno).
- En segundo lugar, desvían la sangre a áreas no ventiladas del pulmón, lo que se denomina desajuste de ventilación-perfusión. Esto significa que la sangre va a partes del pulmón donde no se oxigenará lo suficiente.
Juntas, estas anormalidades reducen el oxígeno en la sangre. Sin embargo, se desconocía la causa de estas anomalías. En 2020, nuestro equipo de 20 investigadores de tres universidades canadienses se dispuso a desentrañar este misterio. Propusimos que el SARS-CoV-2 empeoró la neumonía por COVID-19 al atacar las mitocondrias en las células epiteliales de las vías respiratorias (las células que recubren las vías respiratorias) y las células del músculo liso de la arteria pulmonar .
Ya sabíamos que las mitocondrias no son solo el motor de la célula, sino también sus principales consumidores y sensores de oxígeno . Las mitocondrias controlan el proceso de muerte celular programada (llamada apoptosis) y regulan la distribución del flujo sanguíneo en los pulmones mediante un mecanismo llamado vasoconstricción pulmonar hipóxica.
Este mecanismo tiene una función importante. Dirige la sangre lejos de las áreas de neumonía a lóbulos del pulmón mejor ventilados, lo que optimiza la absorción de oxígeno. Al dañar las mitocondrias en las células del músculo liso de la arteria pulmonar, el virus permite que el flujo sanguíneo continúe hacia las áreas de neumonía, lo que también reduce los niveles de oxígeno.
Parecía plausible que el SARS-CoV-2 estuviera dañando las mitocondrias. Los resultados de este daño (un aumento de la apoptosis en las células epiteliales de las vías respiratorias y la pérdida de la vasoconstricción pulmonar hipóxica) estaban empeorando la lesión pulmonar y la hipoxemia (bajo nivel de oxígeno en la sangre).
Nuestro descubrimiento, publicado en Redox Biology , explica cómo el SARS-CoV-2, el coronavirus que causa la neumonía por COVID-19, reduce los niveles de oxígeno en la sangre.
Mostramos que el SARS-CoV-2 mata las células epiteliales de las vías respiratorias al dañar sus mitocondrias. Esto da como resultado la acumulación de líquido en las vías respiratorias inferiores, lo que interfiere con la absorción de oxígeno. También mostramos que el SARS-CoV-2 daña las mitocondrias en las células del músculo liso de la arteria pulmonar , lo que inhibe la vasoconstricción pulmonar hipóxica y reduce los niveles de oxígeno.
Atacando las mitocondrias
Los coronavirus dañan las mitocondrias de dos maneras: regulando la expresión génica relacionada con las mitocondrias y mediante interacciones directas proteína-proteína. Cuando el SARS-CoV-2 infecta una célula, secuestra la maquinaria de síntesis de proteínas del huésped para hacer nuevas copias del virus. Sin embargo, estas proteínas virales también se dirigen a las proteínas del huésped, lo que hace que funcionen mal . Pronto supimos que muchas de las proteínas celulares del huésped a las que se dirige el SARS-CoV-2 estaban en las mitocondrias.
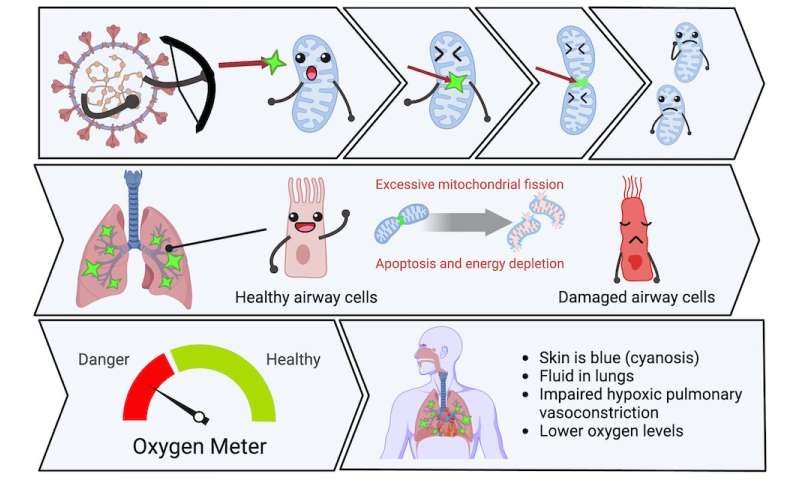
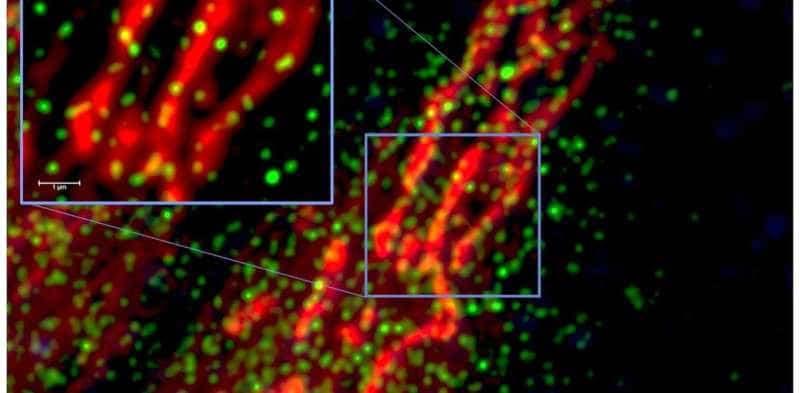
Las proteínas virales fragmentan las mitocondrias, privando a las células de energía e interfiriendo con su capacidad de detección de oxígeno. El ataque viral a las mitocondrias comienza a las pocas horas de la infección, activando genes que rompen las mitocondrias en pedazos (llamada fisión mitocondrial) y hacen que sus membranas tengan fugas (un paso temprano en la apoptosis llamada despolarización mitocondrial).
En nuestros experimentos, no necesitábamos usar un virus replicante para dañar las mitocondrias; la simple introducción de proteínas individuales del SARS-CoV-2 fue suficiente para causar estos efectos adversos. Este daño mitocondrial también ocurrió con otros coronavirus que estudiamos.
Ahora estamos desarrollando fármacos que algún día puedan contrarrestar la COVID-19 al bloquear la fisión mitocondrial y la apoptosis, o al preservar la vasoconstricción pulmonar hipóxica. Nuestros esfuerzos de descubrimiento de fármacos ya nos han permitido identificar un prometedor inhibidor de la fisión mitocondrial, llamado Drpitor1a .
El experto en enfermedades infecciosas de nuestro equipo, Gerald Evans, señala que este descubrimiento también tiene el potencial de ayudarnos a comprender Long COVID. «Las características predominantes de esa afección (fatiga y disfunción neurológica) podrían deberse a los efectos persistentes del daño mitocondrial causado por la infección por SARS-CoV-2», explica.
La batalla evolutiva en curso
Esta investigación también tiene un ángulo evolutivo interesante. Teniendo en cuenta que las mitocondrias alguna vez fueron bacterias, antes de ser adoptadas por las células en la sopa primordial , nuestros hallazgos revelan un escenario Alien versus Predator en el que los virus atacan a las «bacterias».
Las bacterias son atacadas regularmente por virus, llamados bacteriófagos, que necesitan un huésped para replicarse. Las bacterias, a su vez, contraatacan, utilizando una forma antigua de sistema inmunológico llamada sistema CRISPR-cas, que corta el material genético de los virus. Los humanos han explotado recientemente este sistema CRISPR-cas para un descubrimiento de edición de genes ganador del Premio Nobel .
La competencia en curso entre bacterias y virus es muy antigua; y recordar que nuestras mitocondrias alguna vez fueron bacterias. Entonces, quizás no sea sorprendente en absoluto que el SARS-CoV-2 ataque nuestras mitocondrias como parte del síndrome COVID-19.
Pivote pandémico
Los miembros originales del equipo de este proyecto son investigadores del corazón y los pulmones con experiencia en biología mitocondrial. A principios de 2020, giramos para aplicar eso en otro campo, la virología, en un esfuerzo por hacer una pequeña contribución al rompecabezas de COVID-19.
El diverso equipo que reunimos también aportó experiencia en biología mitocondrial, fisiología cardiopulmonar, SARS-CoV-2, transcriptómica , química sintética, imágenes moleculares y enfermedades infecciosas .
Nuestro descubrimiento debe mucho a nuestros colaboradores de virología. Al principio de la pandemia, el virólogo Gary Levy de la Universidad de Toronto nos ofreció un coronavirus de ratón (MHV-1) para trabajar, que usamos para hacer un modelo de neumonía por COVID-19. Che Colpitts, virólogo de la Universidad de Queen, nos ayudó a estudiar la lesión mitocondrial causada por otro coronavirus beta humano, HCoV-OC43.
Finalmente, Arinjay Banerjee y su equipo experto en virología del SARS-CoV-2 en la Organización de Vacunas y Enfermedades Infecciosas (VIDO) en Saskatoon realizaron estudios clave del SARS-CoV-2 humano en células epiteliales de las vías respiratorias . VIDO es uno de los pocos centros canadienses equipados para manejar el virus altamente infeccioso SARS-CoV-2.
El experto en microscopía de súper resolución de nuestro equipo, Jeff Mewburn, señala los desafíos específicos con los que tuvo que lidiar el equipo.
«Al tener que seguir numerosos y extensos protocolos de COVID-19, aún pudieron exhibir una flexibilidad increíble para reestructurar y reenfocar nuestro laboratorio específicamente en el estudio de la infección por coronavirus y sus efectos en las funciones celulares/mitocondriales, tan relevantes para nuestra situación global». » él dijo.
Esperamos que nuestro descubrimiento se traduzca en nuevos medicamentos para contrarrestar futuras pandemias.
Más información: Stephen L. Archer et al, La mitocondriopatía por SARS-CoV-2 en la neumonía por COVID-19 exacerba la hipoxemia,
Redox Biology (2022). DOI: 10.1016/j.redox.2022.102508Proporcionado por
Este artículo se vuelve a publicar de The Conversation bajo una licencia Creative Commons. Lee el artículo original .
