Investigadores de la Universitat Autònoma de Barcelona (UAB) han publicado un análisis que revela nuevas funciones de la proteína RAD21L —una cohesina específica de la línea germinal— crucial para la fertilidad masculina. El estudio, realizado en ratones en colaboración con el Consejo Superior de Investigaciones Científicas (CSIC), la Universidad de Salamanca y el Centro Nacional de Análisis Genómico (CNAG) de Barcelona, se publica en la revista Science Advances .
por la Universidad Autónoma de Barcelona
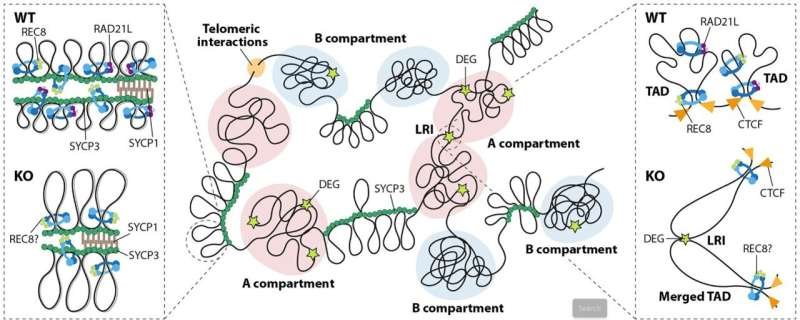
Las cohesinas son complejos proteicos en forma de anillo que rodean el ADN y desempeñan un papel esencial en la división celular , previniendo la pérdida de información genética. Entre ellas se encuentra la proteína RAD21L, que se expresa exclusivamente en células germinales (ovarios y testículos) y es esencial para el apareamiento de cromosomas homólogos durante la recombinación genética . En modelos animales con deficiencias de esta proteína, los investigadores observaron defectos en el apareamiento cromosómico y la acumulación de roturas no reparadas en el ADN, lo que produjo infertilidad masculina.
El estudio demuestra que RAD21L también regula la organización tridimensional del genoma y la expresión génica en las células precursoras del esperma. La ausencia de esta proteína provoca una profunda reorganización de la arquitectura de la cromatina y una desregulación general de la actividad génica, lo que interfiere con el proceso de espermatogénesis y provoca infertilidad.
«Este descubrimiento añade una nueva dimensión a nuestra comprensión de cómo la estructura del genoma influye en la fertilidad, la diversidad genética y la evolución», explica la Dra. Aurora Ruiz-Herrera, catedrática del Departamento de Biología Celular, Fisiología e Inmunología de la UAB, investigadora del Instituto de Biotecnología y Biomedicina (IBB-UAB) e ICREA Academia, que dirigió el estudio.
La investigación se llevó a cabo con ratones modificados genéticamente que carecen de la proteína RAD21L. Mediante técnicas genómicas avanzadas, el equipo analizó la estructura tridimensional del genoma y los niveles de expresión génica en células germinales masculinas. La comparación entre ratones sanos e infértiles permitió demostrar que la falta de RAD21L altera la distribución del ADN en el núcleo celular y desregula genes clave para la formación de espermatozoides.
Según la Dra. Laia Marín Gual, primera autora del estudio e investigadora del IBB-UAB, «lo más sorprendente fue observar cómo la ausencia de RAD21L no solo afecta a la estructura física del genoma, sino que también altera profundamente la actividad de genes implicados en la formación de gametos. Esto nos permite comprender mejor los mecanismos genéticos que pueden estar detrás de ciertos casos de infertilidad masculina».
Implicaciones para la fertilidad humana
Aunque el estudio se realizó en modelos murinos, los investigadores destacan que los mecanismos descubiertos también podrían ser relevantes en humanos. La espermatogénesis es un proceso altamente conservado en mamíferos, y la desregulación de proteínas como RAD21L podría estar involucrada en casos de infertilidad masculina idiopática (sin causa aparente) que afectan a millones de hombres en todo el mundo.
La infertilidad afecta a aproximadamente el 17,5 % de la población adulta mundial, según datos de la Organización Mundial de la Salud (OMS), lo que equivale a 1 de cada 6 personas. Además, estudios recientes muestran una reducción en la concentración de espermatozoides a nivel mundial desde 1973. Estos datos indican que la infertilidad masculina es un problema de salud pública creciente y que su origen genético sigue siendo en gran medida desconocido.
Este hallazgo no solo mejora los conocimientos básicos sobre biología reproductiva, sino que también abre nuevas vías para el diagnóstico genético de la infertilidad masculina. Asimismo, plantea interrogantes sobre el papel evolutivo de RAD21L en la arquitectura y regulación del genoma en diferentes especies, incluidos los humanos.
El equipo de investigación planea profundizar en los mecanismos moleculares mediante los cuales RAD21L regula la organización y la expresión del genoma. Además, estudiar su función en otras especies podría ofrecer nuevos conocimientos sobre la evolución de la fertilidad y el control genético.
Más información: Laia Marín-Gual et al., La cohesión meiótica RAD21L modela la estructura y transcripción del genoma tridimensional en la línea germinal masculina, Science Advances (2025). DOI: 10.1126/sciadv.adv2283
