Un nuevo estudio realizado por científicos del Centro Oncológico Integral Jonsson de UCLA Health ayuda a explicar por qué el glioblastoma, una de las formas más agresivas de cáncer cerebral, se vuelve resistente al tratamiento e introduce un nuevo enfoque que allana el camino para estrategias de tratamiento más personalizadas para pacientes con este tumor cerebral mortal.
por la Universidad de California, Los Ángeles
El método, descrito en Nature Communications , combina el perfil genético , que analiza la composición genética de un tumor, con el perfil funcional, que observa cómo se comportan las células cancerosas en respuesta a los tratamientos. Esta estrategia combinada ayuda a predecir qué tan bien responderá el glioblastoma a los tratamientos e identifica nuevas formas de atacar y tratar los tumores de manera más efectiva.
«Muchos tratamientos contra el cáncer se basan en el perfil genético del tumor del paciente. Sin embargo, las características genómicas por sí solas no siempre pueden predecir cómo responderá un tumor a una terapia», dijo el Dr. David Nathanson, autor principal del estudio y profesor de farmacología molecular y médica en la Escuela de Medicina David Geffen de la UCLA. «Este estudio explora un nuevo enfoque que va más allá del mapa genético del tumor, en el que combinamos datos genéticos con pruebas funcionales para mostrar cómo las células cancerosas vivas responden a los tratamientos. Esto nos da una imagen mucho más clara de qué tratamientos funcionarán y por qué».
El glioblastoma es notoriamente difícil de tratar debido a su capacidad de resistir la muerte celular, un proceso conocido como apoptosis, y su rápida adaptación a las terapias. Si bien la medicina genómica de precisión tradicional utiliza la secuenciación del ADN para identificar mutaciones genéticas en los tumores y asociarlas con terapias dirigidas, este enfoque solo proporciona una instantánea de la posible respuesta del tumor. A menudo no es suficiente para predecir el éxito del tratamiento porque no tiene en cuenta la complejidad genética de los tumores cerebrales ni el comportamiento dinámico de las células cancerosas.
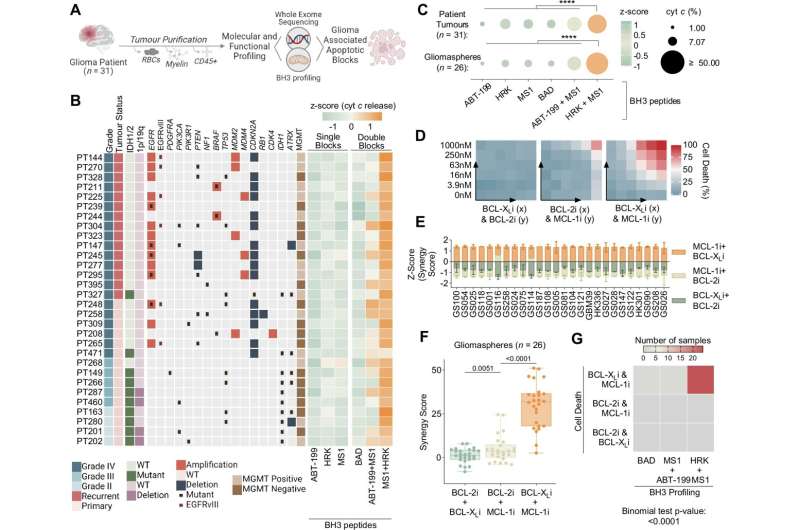
Para superar este desafío, Nathanson y su equipo analizaron la integración de los perfiles funcionales junto con los datos genómicos para examinar la resistencia del glioblastoma a la apoptosis. Para ello, el equipo utilizó una técnica especial denominada perfil BH3 para comprender cómo funciona este sistema en muestras tumorales de pacientes. Al utilizar este método, los científicos pueden medir las respuestas de las células cancerosas a los tratamientos que tienen como objetivo desencadenar la muerte celular en tiempo real.
A través de este análisis, el equipo descubrió que las terapias estándar como la radiación o la quimioterapia pueden cambiar el funcionamiento de la maquinaria de autodestrucción del tumor, pero este efecto depende de características genéticas específicas, como un gen p53 funcional.
Con los conocimientos adquiridos en esta prueba, los investigadores crearon una herramienta de aprendizaje automático llamada GAVA, que combina datos genéticos y funcionales para ayudar a predecir cómo podría responder un tumor de glioblastoma a una combinación de tratamientos específica.
En modelos preclínicos, GAVA ayudó a predecir qué tumores responderían mejor a una combinación de tratamientos oncológicos estándar y medicamentos que bloquean determinadas proteínas. Descubrieron que dirigirse a la proteína BCL-XL, que desempeña un papel importante para ayudar a las células cancerosas a evitar la muerte, podría mejorar la eficacia de los tratamientos en ciertos casos.
Luego, los investigadores probaron un nuevo fármaco experimental llamado ABBV-155, un conjugado anticuerpo-fármaco diseñado para atacar al BCL-XL en los tumores sin afectar a las células sanas.
«Hemos descubierto que la combinación de terapias estándar con ABBV-155 ha inducido con éxito la reducción del tamaño del tumor , algo que rara vez observamos en modelos de glioblastoma clínicamente relevantes», afirmó Nathanson, que también es investigador en el Centro Oncológico Integral Jonsson de UCLA Health. «Los resultados son increíblemente emocionantes y tenemos la esperanza de que este enfoque abra el camino a una nueva terapia para pacientes con esta devastadora enfermedad».
«Los hallazgos abren un camino claro hacia el desarrollo de terapias específicas para cada paciente que podrían mejorar significativamente los resultados de los pacientes diagnosticados con glioblastoma», dijo el Dr. Timothy Cloughesy, profesor distinguido de neurooncología en la Escuela de Medicina David Geffen de la UCLA y coautor del estudio.
Los investigadores ahora están trabajando para probar la combinación en un ensayo clínico para evaluar su impacto en los pacientes.
La primera autora del estudio es Elizabeth Fernández, candidata a doctora en el departamento de Farmacología Molecular y Médica de la UCLA. Otros autores de la UCLA son Wilson Mai, Kai Song, Nicholas Bayley, Jiyoon Kim, Henan Zhu, Marissa Pioso, Pauline Young, Cassidy Andrasz, Dimitri Cadet, Linda Liau, Gang Li, William Yong, Fausto Rodríguez, Jingyi Jessica Li y Thomas Graeber.
Más información: Elizabeth G. Fernandez et al, Caracterización molecular y funcional integrada de la maquinaria apoptótica intrínseca que identifica vulnerabilidades terapéuticas en gliomas, Nature Communications (2024). DOI: 10.1038/s41467-024-54138-9
