Un equipo dirigido por investigadores del Centro de Cáncer Perlmutter de NYU Langone Health ha identificado un gen que impulsa el desarrollo del segundo tipo más común de carcinoma de pulmón, lo que ofrece una mayor comprensión de cómo se podría tratar la enfermedad.
por NYU Langone Health
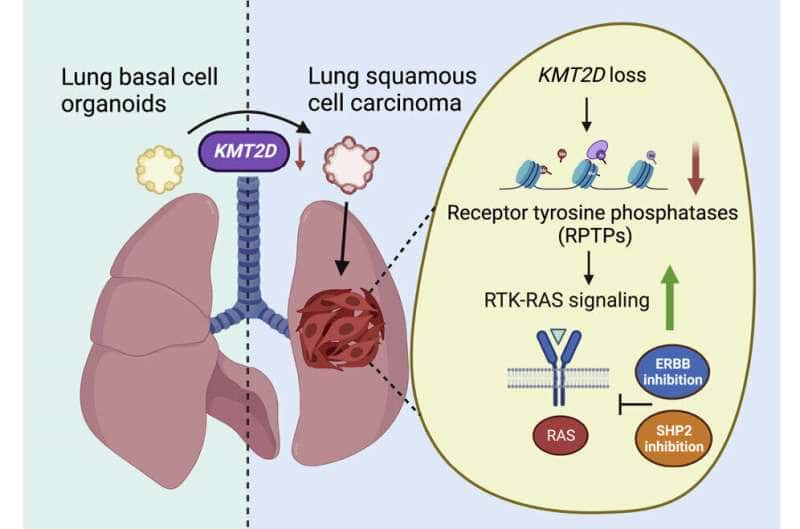
Actualmente no existe una terapia de primera línea dirigida y aprobada para el carcinoma escamoso de pulmón (LUSC, por sus siglas en inglés), un cáncer que se forma en las capas de células que recubren el órgano y es responsable del 20 al 30 por ciento de las muertes por carcinoma de pulmón. Un nuevo estudio, publicado en Cancer Cell , descubrió que la eliminación de un gen llamado KMT2D provocó que las células pulmonares normales (basales) cultivadas en cultivos complejos llamados organoides se transformaran en células LUSC.
Según los autores del estudio, KMT2D regula la actividad de los genes que permiten la construcción de proteínas tirosina fosfatasas, enzimas que restringen las señales que fomentan el crecimiento celular enviadas a través de otro conjunto de enzimas llamado receptor tirosina quinasa (RTK). Se sabe que dos RTK, llamados EGFR y ERBB2, participan en la activación anormal de la vía de señalización RTK-RAS, en la que un interruptor molecular se «atasca en el modo encendido», lo que hace que las células se multipliquen continuamente como parte del cáncer.
«Nuestro estudio identifica a KMT2D como un contribuyente fundamental para el desarrollo de cánceres escamosos de pulmón y ofrece pistas vitales sobre cómo atacar LUSC deficientes en KMT2D», dice el coautor correspondiente Kwok Kin-Wong, MD, Ph.D., director de la División de Hematología y Oncología Médica de NYU Langone Health. «Los mismos cambios genéticos que hacen que el gen contribuya al cáncer también crean tumores que son muy sensibles a los medicamentos existentes que se dirigen a una vía relacionada».
Nuevos enfoques sugeridos
El nuevo estudio confirma la evidencia previa de que el gen KMT2D codifica una proteína (una histona metiltransferasa) que determina el grado en que la maquinaria celular puede acceder a los genes de la tirosina fosfatasa al tratar de leerlos.
Dada la mejor comprensión de los mecanismos LUSC resultantes del nuevo estudio, el equipo de investigación decidió probar en ratones de estudio una combinación de dos fármacos: el inhibidor SHP2 SHP099 y el inhibidor pan-ERBB afatinib.
ERBB se vuelve más activo debido a los defectos de señalización de KMT2D, y la enzima SHP activa la vía RTK-KAS, al igual que EGFR y ERBB2, que se vuelven más activos por la falta de KMT2D. El equipo razonó que los medicamentos experimentales diseñados para inhibir SHP también podrían contrarrestar el efecto de la deficiencia de KMT2D cuando se usan junto con el inhibidor de ERBB.
De hecho, descubrieron que la combinación ralentizaba el crecimiento de tumores de pulmón en ratones con LUSC que habían sido diseñados para carecer de KMT2D, así como en tumores en ratones derivados de tumores LUSC humanos con mutaciones en KMT2D.
«Múltiples inhibidores de SHP2 se están probando actualmente en ensayos clínicos, y el afatinib ya está disponible», dice el coautor correspondiente Hua Zhang, MD, Ph.D., ex instructor en el Departamento de Medicina de NYU Langone Health, y ahora asistente. profesor en el Departamento de Medicina, División de Hematología y Oncología, en la Facultad de Medicina de la Universidad de Pittsburgh y en el Centro de Cáncer UPMC Hillman. «Nuestros hallazgos justifican el diseño de ensayos clínicos que prueben estas terapias en pacientes con LUSC con deficiencia de KMT2D».
Más información: Yuanwang Pan et al, La deficiencia de KMT2D provoca carcinoma de células escamosas de pulmón e hipersensibilidad a la inhibición de RTK-RAS,
Cancer Cell (2022).
DOI: 10.1016/j.ccell.2022.11.015
