Los inmunólogos y genetistas del UT Southwestern Medical Center han descubierto cómo la vitamina A ingresa a las células inmunes en los intestinos, hallazgos que podrían ofrecer información para tratar enfermedades digestivas y quizás ayudar a mejorar la eficacia de algunas vacunas.
por UT Southwestern Medical Center
«Ahora que sabemos más sobre este importante aspecto de la función inmunológica, eventualmente podremos manipular la forma en que la vitamina A se entrega al sistema inmunológico para el tratamiento o la prevención de enfermedades», dijo la investigadora del Instituto Médico Howard Hughes, Lora Hooper, Ph.D. , Presidente de Inmunología en UT Southwestern.
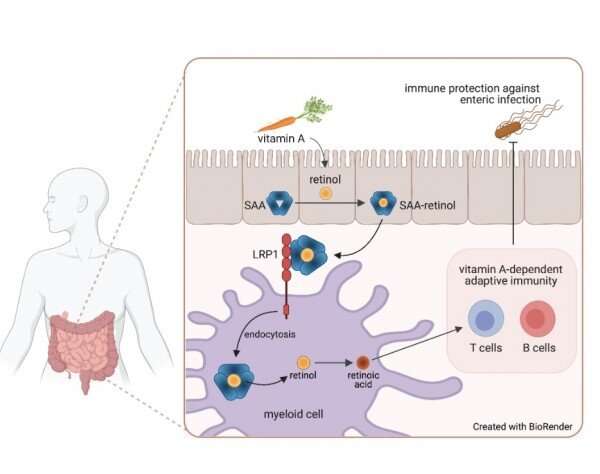
La vitamina A, un nutriente liposoluble que el cuerpo convierte en una molécula llamada retinol y luego en ácido retinoico antes de que pueda usarse, es importante para todos los tejidos del cuerpo, dijo el Dr. Hooper, profesor de inmunología, microbiología y en el Centro de Genética de Defensa del Huésped en UT Southwestern. Es particularmente crucial para el sistema inmunológico adaptativo, un subconjunto del sistema inmunológico más amplio que reacciona a patógenos específicos basados en la memoria inmunológica, el tipo formado por la exposición a enfermedades o vacunas.
Aunque los investigadores sabían que algunas células inmunes intestinales llamadas células mieloides pueden convertir el retinol en ácido retinoico, la forma en que adquieren el retinol para realizar esta tarea era un misterio, dijo el Dr. Hooper, cuyo laboratorio investiga cómo las bacterias intestinales residentes influyen en la biología de los seres humanos y otros mamíferos. Hospedadores.
El autor principal, Ye-Ji Bang, Ph.D., becario postdoctoral en el Hooper Lab, y sus colegas se centraron en las proteínas amiloide A séricas, una familia de proteínas que se unen al retinol que algunos órganos producen durante las infecciones. Utilizaron técnicas bioquímicas para determinar a qué proteínas de la superficie celular se unían e identificaron la proteína 1 relacionada con el receptor de LDL (LRP1).
LRP1 fue descubierto hace más de 30 años por el investigador de UT Southwestern Joachim Herz, MD, Director del Centro de Investigación de Neurodegeneración Traslacional y Profesor de Genética Molecular, Neurología y Neurociencia. El laboratorio de Herz se centra en los mecanismos moleculares mediante los cuales los miembros de la familia de genes del receptor de LDL funcionan como receptores endocíticos y de señalización en el cerebro y la pared vascular. El descubrimiento del receptor de LDL, realizado en UT Southwestern, ayudó a que Michael Brown, MD y Joseph Goldstein, MD, obtuvieran el Premio Nobel de Fisiología o Medicina de 1985.
Drs. Bang, Hooper, Herz y sus colegas demostraron que LRP1 estaba presente en las células mieloides intestinales, donde parecía transportar retinol al interior. Cuando los investigadores utilizaron técnicas genéticas para eliminar el gen de este receptor en ratones, evitando que sus células mieloides absorbieran el derivado de la vitamina A, el sistema inmunológico adaptativo en su intestino prácticamente desapareció, dijo el Dr. Hooper. Las células T y B y la molécula de inmunoglobulina A, componentes críticos de la inmunidad adaptativa, se redujeron significativamente. Luego, los investigadores compararon la respuesta a la infección por Salmonella entre los ratones con LRP1 y los que no lo tenían. Aquellos que no tenían el receptor fueron rápidamente vencidos por la infección.
Los hallazgos, publicados en Science , sugieren que LRP1 es el vehículo por el cual el retinol ingresa a las células mieloides . Si los investigadores pueden desarrollar una forma de inhibir este proceso, dijo el Dr. Hooper, podría reducir la respuesta inmunitaria en enfermedades inflamatorias que afectan los intestinos, como la enfermedad inflamatoria intestinal y la enfermedad de Crohn. Alternativamente, encontrar una forma de mejorar la actividad de LRP1 podría impulsar la actividad inmunológica, haciendo que las vacunas orales sean más efectivas.
Otros investigadores de UTSW que contribuyeron a este estudio incluyen a Zehan Hu, Yun Li, Sureka Gattu, Kelly A. Ruhn y Prithvi Raj.
