En pacientes obesos se observa con frecuencia una disminución del metabolismo y la resistencia del músculo esquelético, pero el mecanismo subyacente no se comprende bien.
por la Universidad de Hong Kong
Un equipo de investigación dirigido por el Dr. Chi Bun Chan, profesor asistente de la Facultad de Ciencias Biológicas de la Facultad de Ciencias de la Universidad de Hong Kong (HKU), descubre un nuevo mecanismo para explicar cómo la obesidad pone en peligro las funciones del músculo esquelético y proporciona un potencial tratamiento contra la enfermedad. Los resultados de la investigación se han publicado recientemente en la revista Autophagy .
La obesidad es un trastorno metabólico con una prevalencia creciente en la sociedad moderna. Desde la década de 1970, el número mundial de personas obesas se ha triplicado y alcanzó los 650 millones (aproximadamente el 13% de la población mundial total) en 2016. Es ampliamente conocido que la obesidad provoca resultados perjudiciales en múltiples órganos humanos y causa numerosos trastornos crónicos como diabetes, hipertensión, enfermedades del hígado graso y aterosclerosis. El metabolismo de las grasas en el músculo esquelético de los pacientes obesos es más lento que el de las personas sanas, lo que los científicos creen que es una consecuencia de funciones anormales en las mitocondrias (las centrales eléctricas de una célula que convierte los nutrientes en energía biológica). Sin embargo, cómo la obesidad afecta la actividad de las mitocondrias es una cuestión sin resolver desde hace mucho tiempo.
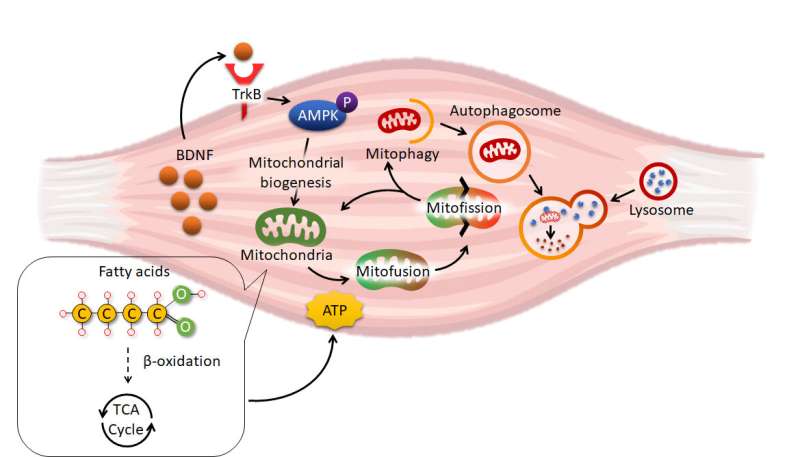
Para estudiar los impactos funcionales de la obesidad en el músculo esquelético, el equipo del Dr. Chan desarrolló un modelo especial de ratón obeso mediante la eliminación del gen del factor neurotrófico derivado del cerebro (BDNF) exclusivamente en su músculo esquelético. El BDNF se identificó originalmente como un factor de crecimiento importante para mantener la supervivencia y las actividades de las neuronas. Estudios recientes han propuesto que el BDNF también es una proteína secretada por el músculo (es decir, mioquina), pero se desconoce su importancia fisiológica.
Por primera vez, el equipo del Dr. Chan descubrió que la obesidad reducía la cantidad de BDNF en el músculo esquelético de los ratones . También observaron que los ratones sin BDNF en su músculo, llamados «MBKO» (Knockout de BDNF específico del músculo), ganaron más peso corporal y desarrollaron una resistencia a la insulina más severa cuando los animales fueron alimentados con una dieta alta en grasas. Además, el equipo de investigación descubrió que los ratones MBKO gastan menos energía que su cohorte de control.
Utilizando una serie de análisis bioquímicos, histológicos, metabolómicos y moleculares, el equipo de investigación demostró además que las mitocondrias de los músculos de los ratones MBKO no podían reciclarse, lo que provocaba la acumulación de mitocondrias dañadas en los tejidos. En consecuencia, el metabolismo de los lípidos en el músculo de los ratones MBKO se ralentizó, lo que provocó que una mayor acumulación de lípidos interfiriera con la sensibilidad a la insulina.
«Claramente, el BDNF derivado de los músculos es una proteína que controla el peso al aumentar el gasto de energía y mantener la sensibilidad a la insulina», dijo el Dr. Chan.
«El BDNF se ha considerado durante mucho tiempo un péptido localizado en el cerebro y se ha subestimado su importancia en los tejidos periféricos. Nuestro estudio proporciona una nueva perspectiva de esta área y, con suerte, podemos desbloquear más funciones de esta mioquina utilizando nuestros ratones MBKO», dijo el Dr. Chan añadió más.
Además de los estudios en animales, el equipo del Dr. Chan también utilizó modelos de células cultivadas para identificar el mecanismo molecular del recambio mitocondrial defectuoso en las células musculares deficientes en BDNF. Descubrieron que el BDNF secretado por los músculos usaba la proteína quinasa activada por AMPK, el conocido sensor de energía en las células, para activar la vía Parkin / PINK1 para inducir la mitofagia (un mecanismo altamente regulado para reciclar los materiales en las células en respuesta a varios desafíos). en el músculo esquelético .
Para extender estos hallazgos a la aplicación terapéutica, el equipo de investigación probó si la restauración de la señalización del BDNF en el músculo rescataría el daño mitocondrial inducido por la obesidad. Alimentaron a los ratones obesos con 7,8-dihidroxiflavona, un mimético de BDNF biodisponible natural en plantas (que se encuentra en las hojas de Godmania aesculifolia, una especie de planta en América del Sur) que se utiliza actualmente en los ensayos clínicos de la enfermedad de Alzheimer, y encontraron que la obesidad- Se alivió la disfunción mitocondrial inducida.
Junto con los hallazgos anteriores de que el 7,8-DHF es un agente eficaz para reducir el peso corporal y mejorar la sensibilidad a la insulina en ratones obesos ( Chem Biol 2015 22: 355-369; Metabolism 2018 87: 113-122), el trabajo del Dr. Chan proporciona una nueva explicación sobre la naturaleza perniciosa de la obesidad y sugiere que el potenciador de la señalización del BDNF, como el 7,8-DHF, es un fármaco potencial para el tratamiento de la obesidad en los seres humanos.
