Un nuevo estudio de la Facultad de Medicina de la Universidad de California en San Diego ofrece un modelo biológico unificado para explicar cómo las predisposiciones genéticas y las exposiciones ambientales convergen para causar el trastorno del espectro autista (TEA).
por Lizelda López, Universidad de California – San Diego
El estudio, publicado en Mitochondrion , describe un modelo de señalización metabólica de tres impactos que replantea el autismo como un trastorno tratable de la comunicación celular y el metabolismo energético. El modelo también sugiere que hasta la mitad de los casos de autismo podrían prevenirse o reducirse con intervenciones prenatales y en la primera infancia.
«Nuestros hallazgos sugieren que el autismo no es el resultado inevitable de un gen o exposición en particular, sino el resultado de una serie de interacciones biológicas, muchas de las cuales pueden modificarse», afirmó el autor del estudio, Dr. Robert K. Naviaux, profesor de medicina, pediatría y patología en la Facultad de Medicina de la Universidad de California en San Diego.
«Al comprender cómo estos factores genéticos y ambientales se combinan para alterar la trayectoria del desarrollo de un niño, podemos empezar a imaginar cuidados preventivos y nuevos enfoques de tratamiento que antes se creían imposibles».
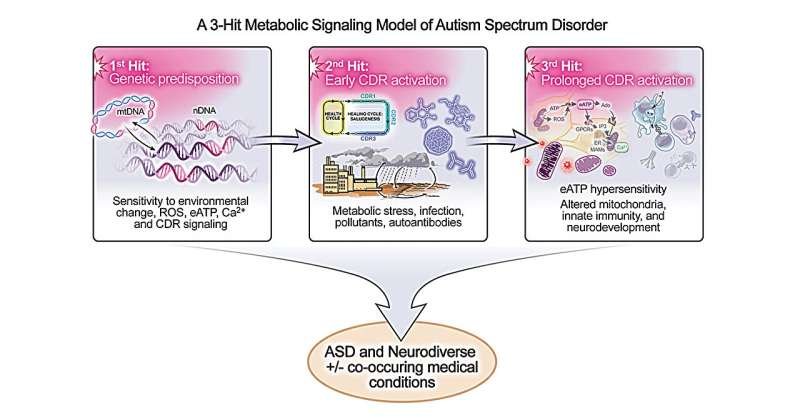
El modelo de los tres hits explicado
El modelo de los tres impactos, desarrollado a partir de más de una década de investigación en biología de sistemas, propone que el autismo se desarrolla cuando se alinean tres condiciones:
- Predisposición genética: los genes heredados pueden hacer que las mitocondrias y ciertas vías de señalización celular sean inusualmente sensibles al cambio.
- Desencadenante temprano: Las exposiciones ambientales (como la infección materna o infantil temprana, el estrés inmunológico o la contaminación) pueden activar una respuesta de estrés celular universal, llamada respuesta de peligro celular (CDR).
- Activación prolongada: cuando esta respuesta celular al estrés permanece activada durante demasiado tiempo (normalmente debido a la exposición repetida o continua a factores estresantes desde el final del embarazo hasta los primeros dos o tres años de vida), puede interferir con el desarrollo normal del cerebro y provocar TEA.
En el centro de este modelo se encuentra la CDR , un proceso metabólico que ayuda a las células a recuperarse de lesiones o infecciones, responder a amenazas y adaptarse a condiciones cambiantes. La CDR normalmente tiene una vida corta: se activa para promover la curación y se desactiva una vez que el peligro ha pasado. Sin embargo, cuando la respuesta se vuelve crónica (debido a factores estresantes persistentes o hipersensibilidad hereditaria), puede interrumpir la comunicación celular y alterar la función mitocondrial.
Esto sucede a través de cambios en el ATP extracelular (eATP), una señalización purinérgica relacionada (señales químicas que las células usan para comunicar el estrés y coordinar la curación), que puede interferir con la forma en que se forman los circuitos cerebrales durante la vida temprana y contribuir a las características centrales del autismo.
«El comportamiento tiene una base química», dijo Naviaux. «El CDR regula esa química. Cuando permanece activado demasiado tiempo, desvía los recursos del cuerpo del crecimiento y desarrollo normales hacia la defensa celular, dejando menos recursos para el cerebro en desarrollo».
Integrando genética, medio ambiente y prevención
Este marco sistémico integra décadas de hallazgos sobre el autismo —desde la disfunción mitocondrial e inmunitaria hasta los cambios en el microbioma intestinal y la hipersensibilidad sensorial— en una única narrativa biológica. Ayuda a explicar por qué tanto los genes como el entorno influyen en el riesgo de autismo, y por qué ninguno de ellos por sí solo es suficiente para causar la enfermedad.
Naviaux sostiene que esta perspectiva aleja la búsqueda de un único «gen del autismo» y se centra en comprender cómo diversos factores estresantes convergen en vías bioquímicas comunes.
«Los mismos sistemas de señalización que permiten a las células responder a una lesión o infección también regulan la formación de circuitos neuronales en el desarrollo temprano», dijo.
Debido a que el segundo y el tercer «impacto» (desencadenantes ambientales y activación prolongada del CDR) son potencialmente reversibles, la detección temprana y la intervención podrían reducir drásticamente el riesgo de autismo.
Para ilustrar cómo múltiples impactos metabólicos pueden acumularse y causar enfermedades, Naviaux compara el autismo con la fenilcetonuria (PKU), un trastorno genético clásico que causa discapacidad intelectual si no se trata. La PKU también sigue el modelo metabólico de tres impactos: si se detecta y trata a tiempo, el 95 % de los niños afectados se desarrollan con normalidad a pesar de ser portadores de un gen causante de la enfermedad. De igual manera, Naviaux estima que si se identifican y se apoyan a tiempo los embarazos y los bebés con mayor riesgo de autismo, entre el 40 % y el 50 % de los casos podrían prevenirse o mejorar significativamente.
Las estrategias potenciales incluyen la detección presintomática, como el perfil metabolómico materno, pruebas de autoanticuerpos y análisis especializados en recién nacidos para identificar a los niños en riesgo antes de que aparezcan los síntomas.
Implicaciones para futuras investigaciones y tratamientos
El estudio surge en medio de una creciente prevalencia del autismo y un debate continuo sobre sus causas. Al replantear el TEA como una condición neurometabólica y neuroinmune, en lugar de una estrictamente genética o conductual, Naviaux espera superar las barreras científicas y fomentar nuevas colaboraciones en materia de prevención y terapia.
Las investigaciones futuras, afirmó, deberían centrarse en perfeccionar las herramientas de diagnóstico que permitan detectar el estrés metabólico antes de que aparezcan los síntomas y en probar terapias que reequilibren los sistemas energéticos y de señalización del organismo. Naviaux aboga por el desarrollo de nuevos fármacos antipurinérgicos para regular la señalización anormal del ATP que activa y mantiene la CDR.
También se necesitan ensayos clínicos más amplios y multicéntricos para evaluar estos nuevos fármacos y estrategias de apoyo metabólico en niños con TEA. Naviaux también aboga por programas de detección prenatal y temprana que combinen datos genéticos, metabolómicos y ambientales para identificar con mayor prontitud a las familias en riesgo.
En conjunto, estos esfuerzos podrían ayudar a determinar si calmar la respuesta celular al peligro puede prevenir o reducir las características más discapacitantes del autismo.
«Comprender el autismo a través de la señalización metabólica no solo cambia nuestra perspectiva sobre la enfermedad, sino también lo que podemos hacer al respecto», afirmó Naviaux. «Si logramos reconocer y calmar la respuesta celular al estrés antes de que se cronifique, podríamos mejorar o incluso prevenir algunos de los síntomas más incapacitantes».
Más información: Robert K. Naviaux, Un modelo de señalización metabólica de 3 hits para los síntomas principales del trastorno del espectro autista, Mitochondrion (2026). DOI: 10.1016/j.mito.2025.102096
Leyenda de imagen: Un modelo de señalización metabólica de tres impactos que replantea el autismo como un trastorno tratable de la comunicación celular y el metabolismo energético. Crédito: Universidad de California – San Diego
Nota editorial:
Este artículo ha sido elaborado con fines divulgativos a partir de información pública y fuentes especializadas, adaptado al enfoque editorial del medio para facilitar su comprensión y contextualización.
