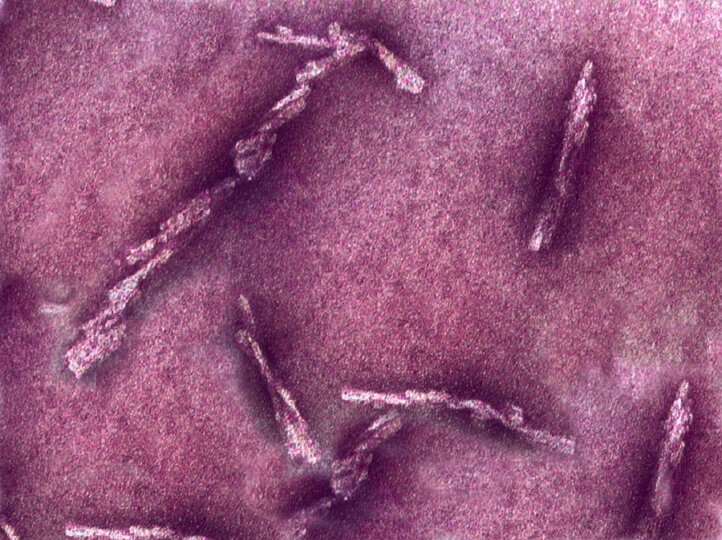
Los investigadores de la Universidad Case Western Reserve que estudian los priones, proteínas mal plegadas que causan enfermedades letales incurables, han identificado por primera vez las características de la superficie de los priones humanos responsables de su replicación en el cerebro.
por la Universidad Case Western Reserve
El objetivo final de la investigación es ayudar a diseñar una estrategia para detener la enfermedad priónica en humanos y, en última instancia, traducir nuevos enfoques para trabajar en el Alzheimer y otras enfermedades neurodegenerativas .
Los científicos aún tienen que descubrir la causa exacta de la enfermedad de Alzheimer, pero están de acuerdo en que los problemas de proteínas juegan un papel en su aparición y progresión. La enfermedad de Alzheimer afecta a más de 6 millones de personas en los EE. UU., Y la Asociación de Alzheimer estima que su atención costará aproximadamente $ 355 mil millones este año.
La investigación se realizó en el Laboratorio Safar en el Departamento de Patología y el Centro de Proteómica y Bioinformática de la Facultad de Medicina de la Universidad Case Western Reserve, y en el Centro de Biociencia Sincrotrón de Case Western Reserve en los Laboratorios Brookhaven en Nueva York. Jiri Safar, profesor de patología, neurología y neurociencias de la Facultad de Medicina de Case Western Reserve, dirige el trabajo. El informe, «Los dominios externos estructuralmente distintos impulsan la replicación de los principales priones humanos», se publicó en la edición del 17 de junio de PLOS Pathogens .
Los priones se descubrieron por primera vez a fines de la década de 1980 como un agente biológico que contenía proteínas y que podía replicarse en células vivas sin ácido nucleico. El impacto en la salud pública de las enfermedades priónicas humanas de transmisión médica —y también las transmisiones animales de priones de encefalopatía espongiforme bovina (EEB, » enfermedad de las vacas locas » )— aceleró dramáticamente el desarrollo de un nuevo concepto científico de proteína autorreplicante.
Los priones humanos pueden unirse a proteínas normales vecinas en el cerebro y causar agujeros microscópicos. En esencia, convierten los cerebros en estructuras esponjosas y conducen a la demencia y la muerte. Estos descubrimientos llevaron al debate científico en curso sobre si los mecanismos similares a los priones pueden estar involucrados en el origen y la propagación de otros trastornos neurodegenerativos en los seres humanos.
«Las enfermedades causadas por priones humanos son posiblemente los trastornos neurodegenerativos más heterogéneos, y un creciente cuerpo de investigación indica que son causadas por distintas cepas de priones humanos», dijo Safar. «Sin embargo, los estudios estructurales de priones humanos se han quedado rezagados con respecto al progreso reciente en priones de laboratorio de roedores, en parte debido a sus complejas características moleculares y los requisitos prohibitivos de bioseguridad necesarios para investigar enfermedades que son invariablemente fatales y no tienen tratamiento».
Los investigadores desarrollaron un nuevo proceso de tres pasos para estudiar los priones humanos:
- Los priones derivados del cerebro humano se expusieron por primera vez a un haz de rayos X de sincrotrón de alta intensidad. Ese rayo creó especies de radicales hidroxilo que, con breves ráfagas de luz, cambiaron de forma selectiva y progresiva la composición química de la superficie del prión. Las propiedades únicas de este tipo de fuente de luz incluyen su enorme intensidad; puede ser millones de veces más brillante que la luz del sol a la Tierra.
- Las rápidas modificaciones químicas de los priones por breves ráfagas de luz se controlaron con anticuerpos anti-priones. Los anticuerpos reconocen las características de la superficie del prión y la espectrometría de masas que identifica los sitios exactos de diferencias basadas en cepas específicas de priones, lo que proporciona una descripción aún más precisa de los defectos del prión.
- A continuación, se permitió que los priones iluminados se replicaran en un tubo de ensayo. La pérdida progresiva de su actividad de replicación a medida que el sincrotrón los modifica ayudó a identificar los elementos estructurales clave responsables de la replicación y propagación de los priones en el cerebro.
«El trabajo es un primer paso crítico para identificar sitios de importancia estructural que reflejen diferencias entre priones de diferente diagnóstico y agresividad», dijo Mark Chance, vicedecano de investigación de la Facultad de Medicina y co-investigador del trabajo. «Por lo tanto, ahora podemos imaginar el diseño de pequeñas moléculas para unirse a estos sitios de nucleación y replicación y bloquear la progresión de la enfermedad priónica humana en los pacientes».
Este enfoque estructural, dijo Chance, también proporciona una plantilla sobre cómo identificar sitios estructuralmente importantes en proteínas mal plegadas en otras enfermedades como el Alzheimer, que implica la propagación de proteínas de una célula a otra de forma similar a los priones.
