Un estudio del Instituto de Salud Carlos III y del CSIC confirma que mutaciones en esta enzima, que regula la topología del ADN bacteriano, es la diana molecular de un nuevo compuesto antimicrobiano que se muestra eficaz frente a varios patógenos respiratorios humanos.

Investigadores del Instituto de Salud Carlos III (ISCIII) y del Consejo Superior de Investigaciones Científicas (CSIC) ha publicado un estudio en la revista International Journal of Molecular Sciences en el que se confirma que la topoisomerasa I, una enzima que regula la topología del ADN bacteriano, es la diana molecular de un nuevo compuesto antimicrobiano, la seconeolitsina.
Este hallazgo ha sido descubierto por investigadoras del ISCIII y se muestra eficaz frente a los patógenos respiratorios humanos Streptococcus pneumoniae y Mycobacterium tuberculosis. Los resultados del trabajo confirman que la topoisomerasa I es una buena para el posible desarrollo de nuevos antibióticos.
La topoisomerasa I regula la topología del ADN bacteriano y es la diana molecular de un nuevo compuesto antimicrobiano:
la seconeolitsina
La investigación se ha llevado a cabo en la bacteria Streptococcus pneumoniae, un importante patógeno humano y principal causante de la neumonía adquirida en comunidad. El incremento de la resistencia a los antibióticos utilizados para combatir las infecciones causadas por esta bacteria ha llevado al estudio una nueva diana de antibióticos, la topoisomerasa I, esencial para el mantenimiento de la topología del ADN.
Para llevar a cabo la investigación, las investigadoras del ISCIII se han valido de ingeniería genética para introducir una determinada mutación en el centro activo de la topoisomerasa I, que es el lugar de interacción de la seconeolitsina. Esta mutación hace a la bacteria más resistente a este compuesto.
Los autores explican que, ante la imposibilidad de sustituir un alelo silvestre por uno mutante en el cromosoma, se comparó la actividad in vivo de las enzimas silvestre y mutante en cepas de S. pneumoniae en las que se manipuló la cantidad de topoisomerasa I mutante y no mutante, bien con un aumento moderado de las enzimas o con un aumento elevado.
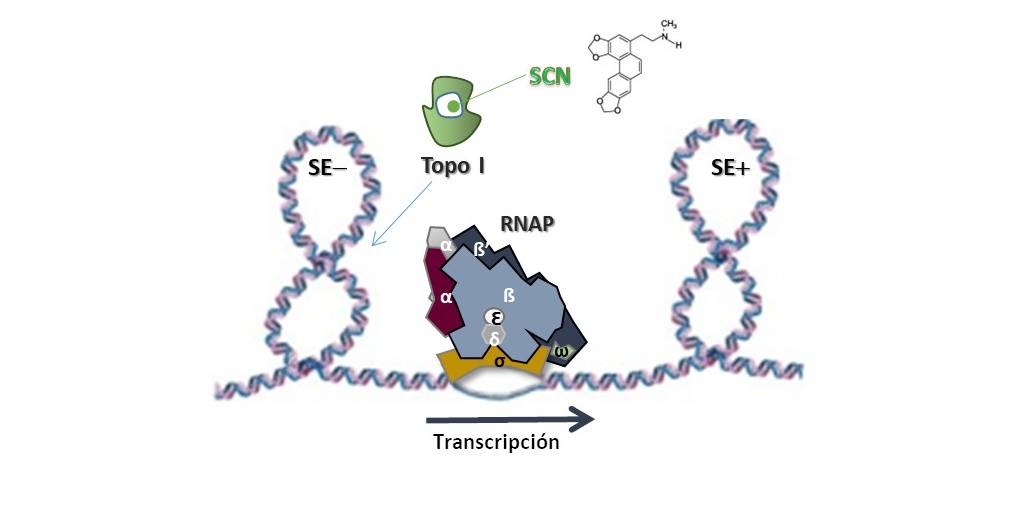
Representación de cómo la actividad de relajación del proceso de superenrollamiento negativo de la topoisomerasa I es esencial para la transcripción llevada a cabo por la ARN polimerasa. / ISCIII
Los resultados de este proceso desvelaron que la enzima mutante mostraba in vitro una actividad reducida, lo que in vivo conducía a una disminución del crecimiento, y que el aumento de la enzima mutante producía una menor relajación.
La transcripción en condiciones de elevada relajación del ADN, que se estimó utilizando técnicas de microscopía confocal de superresolución, y con superproducción de la topoisomerasa I, da lugar a un transcriptoma organizado en dominios que afecta a la mayor parte del genoma de la bacteria. Estos datos permitieron confirmar la implicación de la topoisomerasa I en la transcripción global.
Compactación del ADN de las bacterias
Esta línea de investigación ya había dado resultados previos. A principios de este año, el mismo equipo del ISCIII publicó un artículo en la revista Frontiers in Microbiology que revela que el equilibrio de la actividad de las dos principales enzimas que permiten la compactación del ADN de las bacterias es imprescindible para que las células bacterianas sobrevivan y lleven a cabo sus funciones biológicas.
Este conocimiento básico, relevante para investigar el desarrollo de posibles tratamientos contra infecciones bacterianas, sugiere que una de estas proteínas, la enzima topoisomerasa I, es una buena diana para desarrollar nuevos antibióticos.
Los autores indican que este trabajo “pone de manifiesto que la topoisomerasa I es una diana idónea para el diseño y posible desarrollo de nuevos antibióticos, y que entre las opciones que se abren destaca el posible uso de la seconeolitsina para combatir infecciones respiratorias, ya que este antimicrobiano se une al centro activo de la enzima y dificulta la selección de posibles mutaciones que puedan causar resistencia de resistencia al compuesto”.
Referencia:
García-López, M. et al. “Physiologic and Transcriptomic Effects Triggered by Overexpression of Wild Type and Mutant DNA Topoisomerase I in Streptococcus pneumoniae”. International Journal of Molecular Sciences (2023).
Fuente: ISCIII – Derechos: Creative Commons.
