En casi todos los tumores sólidos (es decir, cánceres con estructura de tejido sólido), la detección de células tumorales en los ganglios linfáticos se considera un marcador decisivo de la progresión de la enfermedad. La afectación ganglionar influye significativamente en la elección del tratamiento y en las probabilidades de supervivencia de los pacientes.
por la Universidad Julio Maximiliano de Würzburg

En particular, los tumores sólidos en la mama, la piel o el tracto gastrointestinal utilizan el sistema linfático como principal vía de metástasis a distancia, por ejemplo, a los pulmones, el hígado y los huesos. Sin embargo, los ganglios linfáticos también desempeñan un papel importante en el sistema inmunitario. Sirven como punto de encuentro para diversas células inmunitarias que cooperan para reconocer y combatir los patógenos.
Esta interfaz entre la metástasis y la inmunidad es precisamente el campo de investigación de la Dra. Angela Riedel, biotecnóloga molecular y jefa de grupo junior en el Centro Mildred Scheel para el Desarrollo Profesional Temprano (MSNZ) del Hospital Universitario de Würzburg (UKW). Acaba de publicar sus últimos descubrimientos en Immunity . Con su pequeño equipo, logró realizar un estudio extenso y exhaustivo que incluyó datos tanto de pacientes como de modelos murinos para generar y fundamentar las hipótesis.
Juntos, examinaron los ganglios linfáticos de modelos murinos y pacientes con cáncer de mama triple negativo (CMTN). Este tipo de cáncer de mama es agresivo y representa entre el 10 % y el 15 % de todos los casos, afectando con frecuencia a mujeres jóvenes. Las terapias estándar dirigidas , como las terapias hormonales modernas, no son una opción en este caso debido a la ausencia de tres características clave.
Ambiente premetastásico en el ganglio linfático: los monocitos se corrompen, los FRC se vuelven cómplices
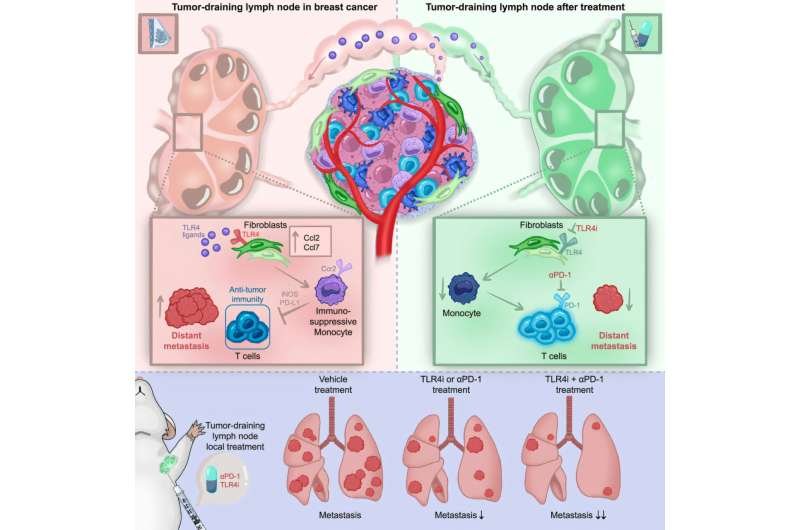
Su investigación se centró en el ganglio linfático que drena el tumor, más cercano al cáncer de mama . Dado que es el primero en filtrar el líquido secretado por el tumor, también se le conoce como ganglio linfático centinela (GLC). Riedel y su grupo de investigación fueron los primeros en demostrar que el tumor manipula el entorno de los ganglios linfáticos que drena incluso antes de asentarse allí. Esto provoca una respuesta inmunitaria alterada, que a su vez promueve el desarrollo de metástasis a distancia.
«Necesitamos comprender mejor la metástasis para prevenirla», enfatiza Riedel. «Esto se debe a que el crecimiento de metástasis en órganos vitales supone un desafío significativo para la curación exitosa de pacientes con cáncer de mama. Sin embargo, al abordar el mecanismo de evasión inmunitaria en los ganglios linfáticos, podemos reducir el riesgo de metástasis».
Su grupo de investigación identificó las células del retículo fibroblástico (CRF) como las principales responsables de la reprogramación de los ganglios linfáticos. Estas células forman la estructura de los ganglios linfáticos y liberan señales especiales a través de las citocinas CCL2 y CCL7 que atraen a los monocitos. Los monocitos son los glóbulos blancos más grandes y desempeñan un papel fundamental en el sistema inmunitario. Sin embargo, el equipo de Riedel observó que los monocitos de los ganglios linfáticos con CMTN se corrompían y bloqueaban la actividad de los linfocitos T, que normalmente se encargan de combatir las células cancerosas.
Los nichos metastásicos proporcionan refugio a las células tumorales
«Utilizando los métodos más modernos, como la transcriptómica espacial, la secuenciación de ARN unicelular, la proteómica y la inmunofluorescencia, que desarrollamos de forma independiente en el laboratorio, pudimos descifrar que estos monocitos supresores se acumulan junto con las células FRC y las células T en nichos específicos dentro de los ganglios linfáticos», informa Moutaz Helal, quien, junto con Greta Mattavelli, es el primer autor de este prestigioso estudio.
Se unió al grupo de Angela Riedel en abril de 2020 como parte de su tesis de maestría y es estudiante de doctorado desde octubre de 2021. Tras completar su licenciatura en farmacia en Egipto, completó su maestría en oncología molecular en el programa de bioquímica de la Universidad de Würzburg. En MSNZ, finalmente descubrió su pasión por la bioinformática. Destaca la excepcional calidad y modernidad de los equipos y las instalaciones centrales del campus de MSNZ.
Pero ¿cómo facilitan las FRC el escape inmunitario y promueven la formación de estos peligrosos nichos premetastásicos? El equipo demostró que las FRC se activan a través del receptor tipo Toll 4 (TLR4). Normalmente, el TLR4 es un sensor en la superficie de las células del sistema inmunitario que actúa como un sistema de alarma, informando de peligros. Sin embargo, a veces los tumores lo utilizan indebidamente para ralentizar el sistema inmunitario.
Menos metástasis en los pulmones debido al bloqueo dirigido de TLR4
El grupo se preguntó: ¿Qué sucede cuando este receptor se bloquea específicamente en el ganglio linfático de drenaje? «Nuestros estudios en ratones demostraron que la inhibición dirigida, combinada con la inmunoterapia moderna con PD1, puede restaurar la actividad de las células T y reducir significativamente la metástasis a distancia en los pulmones», informa Greta Mattavelli.
La científica italiana describe el día en que vio por primera vez el éxito de la terapia en el modelo murino como «un día para recordar». Greta Mattavelli comenzó su doctorado en octubre de 2020 como la primera estudiante de doctorado del grupo de Riedel. Obtuvo su licenciatura y maestría en biotecnología médica y molecular en Milán.
En el estudio, supervisó el trabajo de laboratorio, que a veces requería turnos de noche y trabajo de fin de semana para todo el equipo. Además, conoce perfectamente las rutas que cruzan el campus hacia la clínica ginecológica y el departamento de patología.
En colaboración con el Departamento de Ginecología del UKW, dirigido por el Prof. Dr. Achim Wöckel, y el Instituto de Patología, dirigido por el Prof. Dr. Andreas Rosenwald, el equipo pudo confirmar en muestras de pacientes que el mismo proceso también se observa en pacientes con cáncer de mama triple negativo (CMTN). Esto significa que las terapias dirigidas a este entorno ganglionar también podrían mejorar el pronóstico de las pacientes con cáncer de mama agresivo.
PD-L1 en monocitos de ganglios linfáticos como marcador de inmunoterapia contra PD-1
A principios de 2018, la inmunoterapia, generalmente combinada con quimioterapia, se convirtió en el tratamiento principal recomendado en las guías clínicas para pacientes con tumores primarios PD-L1 positivos. Antecedentes: La proteína de superficie PD-L1 (ligando de muerte programada 1) expresada por el tumor se une al receptor PD-1 de los linfocitos T y les indica que no ataquen al tumor. La inmunoterapia con anticuerpos bloquea esta unión, de modo que el tumor pierde su camuflaje y los linfocitos T del organismo pueden recuperar sus defensas naturales.
Sin embargo, PD-L1 también se encuentra frecuentemente en altas concentraciones en monocitos de ganglios linfáticos premetastásicos. Por lo tanto, la inmunoterapia con PD-1, que libera el freno y reactiva los linfocitos T, también podría ser eficaz en las primeras etapas del cáncer de mama, independientemente del análisis inmunohistoquímico del carcinoma mamario. Según Riedel, la expresión de PD-L1 en las células del ganglio linfático que drena el tumor podría investigarse como marcador para la inmunoterapia con PD-1.
Además, el grupo Riedel está realizando investigaciones adicionales sobre la administración de inmunoterapia: terapia sistémica versus terapia local. En el modelo murino de cáncer de mama, los investigadores ya han observado que la inmunoterapia es más eficaz cuando se administra por vía subcutánea, lo más cerca posible de los ganglios linfáticos. También se está evaluando la elección de la quimioterapia para combinarla con la inmunoterapia. Otro paso es la identificación de grupos de pacientes que se beneficiarían de una inmunoterapia mejorada según su enfoque.
«La Dra. Angela Riedel es una científica excelente y su trabajo es innovador», afirma el Prof. Dr. Achim Wöckel, director del Hospital Universitario de Mujeres de Würzburg.
El cáncer de mama triple negativo sigue siendo una enfermedad muy agresiva a pesar de la eficacia de las terapias debido a sus patrones de metástasis. Me complace enormemente que, junto con el grupo de Riedel, estemos mejorando nuestra comprensión de las interacciones entre las células tumorales y el sistema inmunitario. Este proyecto está vinculado al objetivo a largo plazo de desarrollar opciones terapéuticas innovadoras para prevenir o reducir la propagación del tumor y comprobar su eficacia.
El sistema inmunológico también adquiere cada vez más importancia en el tratamiento cotidiano del cáncer.
Riedel considera no solo emocionante, sino también alentador, que el sistema inmunitario esté adquiriendo cada vez más importancia en el tratamiento del cáncer y otras enfermedades, y que los últimos hallazgos se estén incorporando oportunamente a las recomendaciones terapéuticas. Incluso medidas sencillas como el deporte, el ejercicio, la gestión del estrés y una dieta saludable pueden tener un efecto positivo en el sistema inmunitario y la metástasis.
Existen numerosas publicaciones sobre este tema, incluyendo una suya. Hace tres años, publicó un artículo en la revista Cancer Immunology Research sobre cómo el ácido láctico, liberado por los tumores durante la glucólisis, reprograma los ganglios linfáticos distales y bloquea la respuesta inmunitaria.
En 2024, junto con el Prof. Dr. Leo Rasche, demostró en la revista Blood cómo el microambiente de las células de mieloma y las lesiones extramedulares reacciona de forma diferente al sistema inmunológico.
Más información: El eje fibroblasto-monocito dependiente de TLR4 en los ganglios linfáticos que drenan el tumor contribuye a la metástasis en el cáncer de mama triple negativo, Immunity (2025). DOI: 10.1016/j.immuni.2025.08.015 . www.cell.com/immunity/fulltext … 1074-7613(25)00378-4
Nota editorial:
Este artículo ha sido elaborado con fines divulgativos a partir de información pública y fuentes especializadas, adaptado al enfoque editorial del medio para facilitar su comprensión y contextualización.
