La mayoría de las personas reconocen el Alzheimer por sus devastadores síntomas, como la pérdida de memoria, mientras que los nuevos fármacos se centran en los aspectos patológicos de las manifestaciones de la enfermedad, como las placas de proteínas amiloides. Ahora, un estudio de gran alcance publicado en la revista Cell por investigadores del MIT demuestra la importancia de comprender la enfermedad como una batalla por el control que las células cerebrales ejercen sobre la expresión de sus genes.
por el Instituto Tecnológico de Massachusetts
El estudio pinta un cuadro de alta resolución de una lucha desesperada por mantener la expresión y regulación genética saludables , donde las consecuencias del fracaso o el éxito no son menos que la pérdida o preservación de la función celular y la cognición.
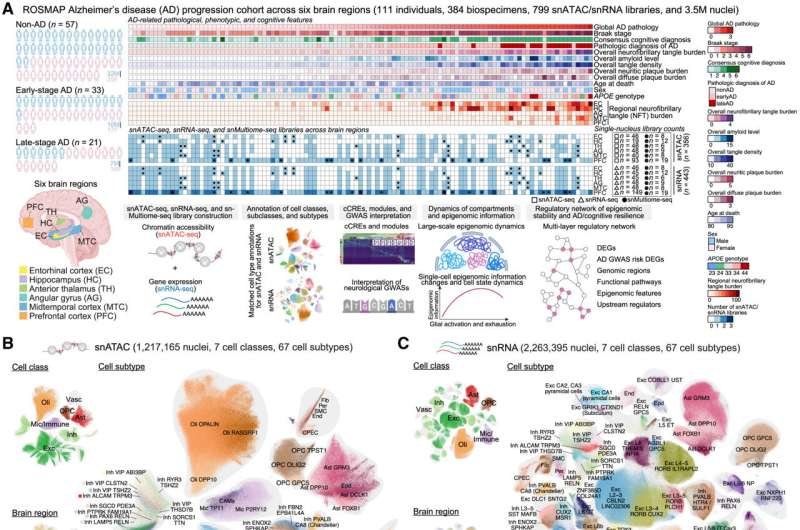
El estudio presenta un atlas multimodal, pionero en su tipo, de expresión y regulación génica combinadas que abarca 3,5 millones de células de seis regiones cerebrales, obtenido mediante el análisis de 384 muestras cerebrales post mortem de 111 donantes. Los investigadores analizaron tanto el «transcriptoma», que muestra qué genes se expresan en ARN, como el «epigenoma», el conjunto de modificaciones cromosómicas que determinan qué regiones del ADN son accesibles y, por lo tanto, utilizadas entre diferentes tipos celulares.
El atlas resultante reveló numerosos hallazgos que demuestran que la progresión del Alzheimer se caracteriza por dos tendencias epigenómicas principales. La primera es que las células vulnerables en regiones cerebrales clave sufren una ruptura de los rigurosos compartimentos nucleares que normalmente mantienen para asegurar que algunas partes del genoma estén abiertas a la expresión, mientras que otras permanecen bloqueadas.
El segundo hallazgo importante es que las células susceptibles experimentan una pérdida de «información epigenómica», lo que significa que pierden el control del patrón único de regulación y expresión genética que les da su identidad específica y permite su funcionamiento saludable.
Junto con la evidencia de una compartimentación comprometida y la erosión de la información epigenómica, hay muchos hallazgos específicos que señalan los circuitos moleculares que se descomponen por tipo de célula, por región y por red genética.
Descubrieron, por ejemplo, que el deterioro de las condiciones epigenómicas facilita la expresión de muchos genes asociados con enfermedades, mientras que si las células logran mantener su epigenómica en orden, pueden controlar los genes asociados con enfermedades. Además, los investigadores observaron claramente que, cuando se producían fallas epigenómicas, las personas perdían capacidad cognitiva, pero donde la estabilidad epigenómica se mantenía, también lo hacía la cognición.
«Para comprender los circuitos, la lógica responsable de los cambios en la expresión genética en la enfermedad de Alzheimer, necesitábamos comprender la regulación y el control previo de todos los cambios que están ocurriendo, y ahí es donde entra en juego el epigenoma», dijo el autor principal Manolis Kellis, profesor del Laboratorio de Ciencias de la Computación e Inteligencia Artificial y jefe del Grupo de Biología Computacional del MIT.
Este es el primer atlas de regulación genética multirregional de células individuales a gran escala de la EA, que analiza sistemáticamente la dinámica de los programas epigenómicos y transcriptómicos a lo largo de la progresión y la resiliencia de la enfermedad.
Al proporcionar ese examen detallado de los mecanismos epigenómicos de la progresión del Alzheimer, el estudio proporciona un modelo para diseñar nuevos tratamientos contra el Alzheimer que puedan dirigirse a los factores subyacentes a la amplia erosión del control epigenómico o a las manifestaciones específicas que afectan a tipos de células clave, como las neuronas y las células gliales de soporte.
«La clave para desarrollar tratamientos nuevos y más eficaces contra el Alzheimer reside en profundizar nuestra comprensión de los mecanismos que contribuyen al deterioro de la función celular y de las redes cerebrales», afirmó Li-Huei Tsai, profesora de Picower y coautora correspondiente, directora del Instituto Picower para el Aprendizaje y la Memoria y miembro fundador de la Iniciativa sobre el Envejecimiento Cerebral del MIT, junto con Kellis. «Estos nuevos datos amplían nuestra comprensión de cómo los factores epigenómicos impulsan la enfermedad».
Los miembros del Laboratorio Kellis, Zunpeng Liu y Shanshan Zhang, son los coautores principales del estudio.
Compartimentos comprometidos e información erosionada
Entre las muestras cerebrales post mortem del estudio, 57 provenían de donantes del Estudio de Órdenes Religiosas o del Proyecto Rush de Memoria y Envejecimiento (conocidos colectivamente como «ROSMAP») que no presentaban patología ni síntomas de EA, mientras que 33 provenían de donantes con patología en etapa temprana y 21 de donantes en etapa avanzada. Por lo tanto, las muestras proporcionaron información valiosa sobre los síntomas y la patología que cada donante presentaba antes de morir.
En el nuevo estudio, Liu y Zhang combinaron análisis de la secuenciación de ARN de células individuales de las muestras, que mide qué genes se expresan en cada célula, y ATACseq, que mide si las regiones cromosómicas son accesibles para la expresión genética.
Consideradas en conjunto, estas medidas transcriptómicas y epigenómicas permitieron a los investigadores comprender los detalles moleculares de cómo se regula la expresión genética en siete amplias clases de células cerebrales (por ejemplo, neuronas u otros tipos de células gliales) y 67 subtipos de células (por ejemplo, 17 tipos de neuronas excitatorias o 6 tipos de neuronas inhibidoras).
Cell (2025). DOI: 10.1016/j.cell.2025.06.031
Los investigadores anotaron más de un millón de regiones de control de la regulación génica que diferentes células emplean para establecer su identidad y funcionalidad específicas mediante el marcado epigenómico. Posteriormente, al comparar las células cerebrales con Alzheimer con las de las que no lo presentan, y teniendo en cuenta el estadio de la patología y los síntomas cognitivos, pudieron establecer asociaciones rigurosas entre la erosión de estos marcados epigenómicos y, en última instancia, la pérdida de función.
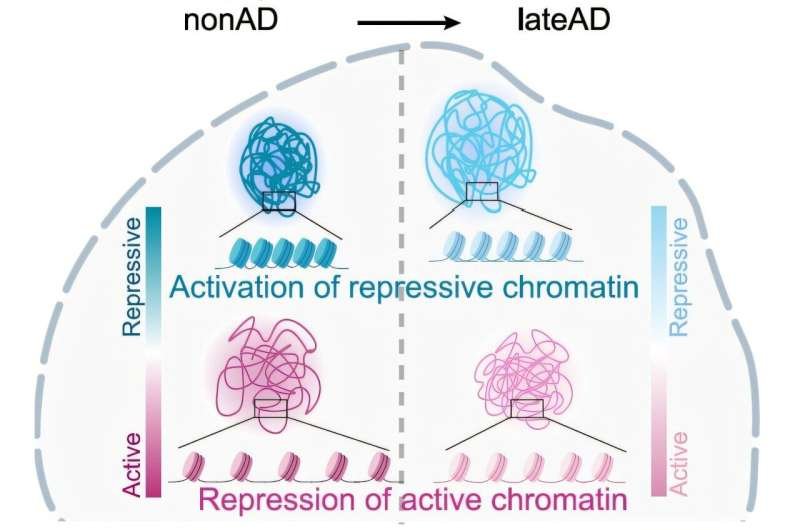
Por ejemplo, observaron que, en personas que alcanzaron la etapa avanzada de la enfermedad de Alzheimer, los compartimentos normalmente represivos se abrieron a una mayor expresión, mientras que los compartimentos que normalmente estaban más abiertos durante la salud se volvieron más reprimidos. Resulta preocupante que, al abrirse los compartimentos normalmente represivos de las células cerebrales, estas se vieran más afectadas por la enfermedad.
«En los pacientes con Alzheimer, los compartimentos represores se abrieron y los niveles de expresión genética aumentaron, lo que se asoció con una disminución de la función cognitiva», explicó el primer autor Zunpeng Liu.
Pero cuando las células lograron mantener sus compartimentos en orden tal que expresaban los genes que debían, las personas permanecieron cognitivamente intactas.
Mientras tanto, basándose en la expresión de los elementos reguladores de las células, los investigadores crearon una puntuación de información epigenómica para cada célula. Generalmente, la información disminuía a medida que la patología progresaba, pero esto era especialmente notable en las células de las dos regiones cerebrales afectadas más tempranamente en el Alzheimer: la corteza entorrinal y el hipocampo.
Los análisis también destacaron tipos específicos de células que eran especialmente vulnerables, incluidas la microglía que cumple funciones inmunes y de otro tipo, los oligodendrocitos que producen aislamiento de mielina para las neuronas y tipos particulares de neuronas excitatorias.
Genes de riesgo y ‘guardianes de la cromatina’
Los análisis detallados del artículo destacaron cómo la regulación epigenómica se correlacionaba con los problemas relacionados con la enfermedad, señaló Liu. La variante e4 del gen APOE, por ejemplo, se considera ampliamente el principal factor de riesgo genético para el Alzheimer. En los cerebros APOE4, la microglía respondió inicialmente a la patología emergente con un aumento en su información epigenómica, lo que sugiere que estaban asumiendo su responsabilidad única de combatir la enfermedad.
Pero a medida que la enfermedad progresaba, las células presentaban una marcada disminución de la información, señal de deterioro y degeneración. Este cambio fue más pronunciado en las personas que tenían dos copias de APOE4, en lugar de una sola. Los hallazgos, según Kellis, sugieren que APOE4 podría desestabilizar el genoma de la microglía, provocando su agotamiento.
Otro ejemplo es el destino de las neuronas que expresan el gen RELN y su proteína reelina. Estudios previos, incluyendo los de Kellis y Tsai, han demostrado que las neuronas que expresan RELN en la corteza entorrinal y el hipocampo son especialmente vulnerables en la enfermedad de Alzheimer, pero promueven la resiliencia si sobreviven. El nuevo estudio arroja nueva luz sobre su destino al demostrar que presentan una pérdida temprana y grave de información epigenómica a medida que la enfermedad avanza, pero que en las personas que mantuvieron resiliencia cognitiva, las neuronas mantuvieron la información epigenómica.
En otro ejemplo, los investigadores rastrearon lo que coloquialmente llaman «guardianes de la cromatina», ya que su expresión sustenta y regula los programas epigenómicos de las células. Por ejemplo, las células con mayor erosión epigenómica y progresión avanzada de la enfermedad de Alzheimer mostraron una mayor accesibilidad a la cromatina en áreas que se suponía estaban bloqueadas por genes de represión de Polycomb u otros silenciadores de la expresión génica. Mientras que las células resilientes expresaban genes que promueven la conectividad neuronal, las células con erosión epigenómica expresaban genes vinculados a la inflamación y el estrés oxidativo.
«El mensaje es claro: el Alzheimer no se trata solo de placas y ovillos, sino de la erosión del propio orden nuclear», afirmó Kellis. «El deterioro cognitivo surge cuando los guardianes de la cromatina pierden terreno ante las fuerzas de la erosión, pasando de la resiliencia a la vulnerabilidad en el nivel más fundamental de la regulación genómica.
«Y cuando nuestras células cerebrales pierden sus marcas de memoria epigenómica y la información epigenómica en el nivel más bajo, en lo profundo de nuestras neuronas y microglia, parece que los pacientes de Alzheimer también pierden su memoria y cognición en el nivel más alto».
Más información: Zunpeng Liu et al., Recableado epigenómico multirregional de células individuales en la progresión de la enfermedad de Alzheimer y la resiliencia cognitiva, Cell (2025). DOI: 10.1016/j.cell.2025.06.031
