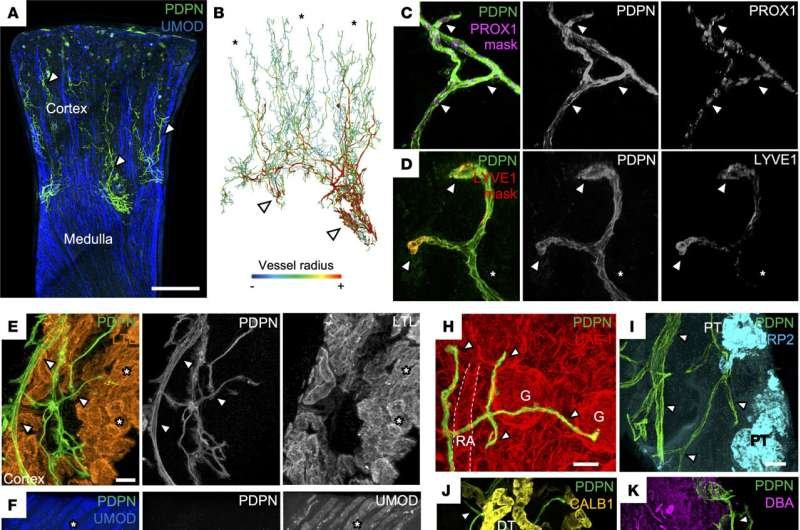
Los científicos han descubierto cómo los vasos linfáticos —el «sistema de tuberías» del riñón— sufren cambios drásticos durante el rechazo crónico del trasplante , desorganizándose estructuralmente y propagándose a partes inusuales del riñón.
por el Wellcome Trust Sanger Institute
Investigadores del Instituto Wellcome Sanger, el University College de Londres (UCL) y la Universidad de Cambridge utilizaron secuenciación de células individuales combinada con potentes imágenes 3D para observar pequeños vasos linfáticos en el tejido renal, comparando riñones sanos con riñones trasplantados que habían sido rechazados.
Publicada en el Journal of Clinical Investigation , la investigación arroja nueva luz sobre un importante desafío no resuelto en el trasplante de riñón y podría abrir la puerta a nuevos tratamientos que ayuden a que los trasplantes duren más.
El trasplante de riñón es el tipo de trasplante de órgano sólido más común en todo el mundo. Si bien los resultados a corto plazo (dentro del año posterior a la cirugía) son muy buenos, los resultados a largo plazo son peores. En un plazo de 10 años, y dependiendo del país donde se trate a los pacientes, aproximadamente el 50 % de los trasplantes de riñón fracasarán.
Los investigadores saben que un factor importante en el fracaso del trasplante de riñón es que el sistema inmunitario del paciente ataca partes del nuevo riñón, como los vasos sanguíneos que lo componen. Sin embargo, la función de los vasos linfáticos es mucho menos conocida. En riñones sanos, los vasos linfáticos actúan como el sistema de tuberías del órgano, desempeñando un papel vital en el drenaje del exceso de líquido y ayudando a regular la actividad inmunitaria. Por lo tanto, los investigadores buscaron comprender mejor el sistema linfático durante el rechazo del trasplante .
El equipo del Instituto Sanger del UCL y sus colaboradores emplearon dos métodos diferentes y potentes: secuenciación de ARN unicelular e imágenes 3D avanzadas. Estudiaron muestras de pacientes sanos y de pacientes con rechazo de trasplantes.
La secuenciación unicelular permite a los científicos estudiar la actividad genética en células individuales , una a una. Los investigadores realizaron esta operación a gran escala para generar una enorme cantidad de datos. Posteriormente, el equipo tiñó grandes fragmentos de tejido renal intacto y utilizó un procedimiento para hacerlo transparente. Esta imagen tridimensional ayudó a validar las predicciones del análisis genético unicelular.
Los investigadores descubrieron que, durante el rechazo de un trasplante de riñón, los vasos linfáticos del mismo cambian su forma y organización. Estos vasos se extienden a partes más profundas del riñón, conocidas como médula, que normalmente carecen de vasos linfáticos. Al mismo tiempo, las uniones celulares, que son anclas proteicas que conectan las células, pasan de parecer botones sueltos a apretarse como cremalleras. Este cambio, en otros contextos, se asocia con células inmunitarias atrapadas e incapaces de escapar.
Además, los investigadores descubrieron que el equilibrio de las células T dentro y alrededor de los vasos se vio alterado. Estas células T liberaron señales que hicieron que los vasos activaran moléculas que actuaban como «frenos» para el sistema inmunitario, en un intento por calmar la inflamación. Sin embargo, esta respuesta protectora no fue suficiente, ya que se observó que otras células inmunitarias y anticuerpos atacaban directamente al riñón. Sorprendentemente, los propios vasos también mostraban señales de estar siendo atacados por los mismos anticuerpos dañinos.
Estos hallazgos desafían la idea de que los vasos linfáticos son simplemente beneficiosos o perjudiciales en el rechazo de trasplantes. Este estudio sugiere que el sistema linfático normalmente protege, pero se ve afectado en el rechazo de trasplantes, ya que los hallazgos muestran que los vasos cambian de maneras que podrían favorecer el rechazo al alterar su estructura y estimular la respuesta inmunitaria. Los resultados abren el camino para que la investigación se centre en la regeneración o protección del sistema linfático en el rechazo renal crónico.
El Dr. Daniyal Jafree, primer autor del Instituto Wellcome Sanger y científico clínico del Instituto de Salud Infantil Great Ormond Street de la UCL, afirmó: «Se puede pensar en los vasos linfáticos como el sistema de tuberías del riñón, que elimina el exceso de líquido, las células inmunitarias y la inflamación. Hasta ahora, nos ha costado comprender realmente la función de estos vasos en el trasplante de riñón debido a su gran dificultad para estudiarlos. Mediante nuevas técnicas de imagen, hemos demostrado que estos vasos experimentan cambios drásticos durante el rechazo y son, en sí mismos, un objetivo del sistema inmunitario».
El profesor David Long, coautor principal, profesor de Nefrología Pediátrica en el Instituto de Salud Infantil Great Ormond Street de la UCL y subdirector temático del Centro de Investigación Biomédica NIHR GOSH, afirmó: «Nuestros métodos innovadores nos han permitido demostrar claramente el importante papel de los vasos linfáticos en el rechazo de trasplantes. Al combinar la secuenciación unicelular con imágenes 3D avanzadas, hemos dado un paso significativo en la investigación sobre trasplantes de riñón».
La profesora Menna Clatworthy, coautora principal y profesora de Inmunología Traslacional en la Universidad de Cambridge y el Instituto Wellcome Sanger, afirmó: «Al descubrir cómo cambian los vasos linfáticos tanto a nivel estructural como molecular, ahora tenemos una visión mucho más clara del entorno inmunitario durante el rechazo de trasplantes. Esto podría ayudarnos a identificar nuevas dianas terapéuticas para preservar los trasplantes de riñón durante más tiempo».
Más información: Daniyal J. Jafree et al., Las características específicas de los órganos de los vasos linfáticos renales humanos se ven alteradas en el rechazo crónico de trasplantes, Journal of Clinical Investigation (2025). DOI: 10.1172/jci168962
